En el estudio de la progresión del glaucoma, se ha establecido que las estrategias terapéuticas conducentes a disminuir la presión intraocular (PIO) siguen siendo beneficiosas para retardar la neuropatía. Sin embargo, también existen casos en los cuales la enfermedad sigue avanzando a pesar de la reducción de la PIO, lo que corresponde a un rango del 25 % al 45 % de los pacientes tratados. Lo anterior ha demostrado que el glaucoma puede manifestarse en cualquier nivel de presión intraocular. Así, surge una mayor atención al estudio del papel de las fuerzas biomecánicas en la fisiopatogenia del glaucoma.
La introducción de la biomecánica en el proceso de generación del glaucoma surge al considerar que todas las células y tejidos están expuestos y, a la vez, responden a fuerzas o cargas que llegan del entorno. En este caso, el interés radica en determinar cómo la PIO afecta la malla trabecular y la cabeza del nervio óptico. Además, se han analizado otras fuentes de carga como la vaina del nervio óptico, la tracción y la presión intracraneal, así como las cargas transmitidas por el fluido cerebroespinal y su relación con la progresión del glaucoma. Ahora bien, es importante comprender que la respuesta de un tejido ante las cargas no depende solamente de la magnitud de esta, puesto que también estará influenciada por las características propias del tejido como su rigidez, compresibilidad y viscoelasticidad. Es decir, la respuesta del tejido también dependerá de factores fenotípicos individuales.
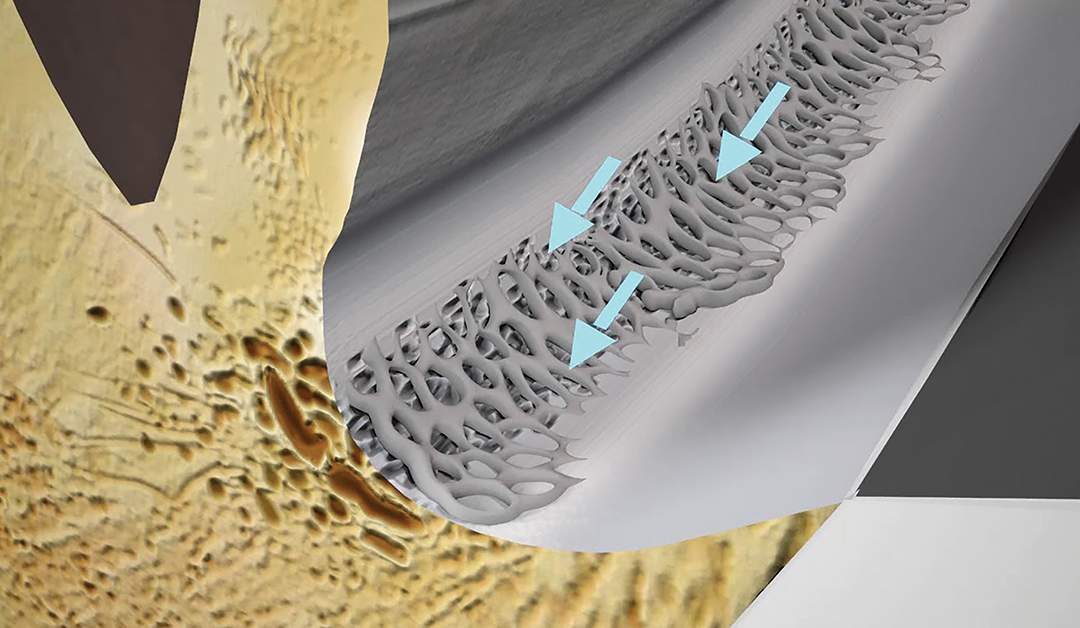
Diferentes estudios han sugerido que en el glaucoma primario de ángulo abierto (GPAA), la enfermedad se produce por la reducción en la evacuación del humor acuoso (HA) a nivel de la malla trabecular (MT). En la actualidad, se sabe que la resistencia a este fluido se da principalmente en la parte externa de la MT y en la pared interna del canal de schlemm. Con lo anterior, se ha deducido que la hipertensión ocular se asocia con diferentes cambios biomecánicos en la MT. Entre ellos, se destacan: aumento de la rigidez de la MT y de los enlaces cruzados de actina, e incremento de acumulación de matriz extracelular (MEC), como sucede en el caso de glaucoma por corticoides.
En investigaciones ex vivo, se ha descrito la diferencia en rigidez de la malla trabecular en tejidos normales y anormales; sin embargo, su aplicación en vivo no es tan sencilla debido a las limitaciones que existen para utilizar tecnologías como la microscopía de fuerza atómica. Pese a ello, los avances en OCT, como el sensible a la fase y la ingeniería computacional, han arrojado nueva luz en el entendimiento al respecto, al detectar diferencias en la motilidad pulsátil de la MT en pacientes con GPAA.
Uno de los factores que se ha estudiado es el papel de Piezo 1, el cual consiste en un canal iónico mecanosensible, especialmente sensible al estiramiento, y se expresa en la MT y células ganglionares de la retina en humanos. Cuando se activa Piezo 1, se disminuye la capacidad contráctil de las células de la MT y facilita la evacuación del humor acuoso en respuesta al estímulo mecánico. Otro canal iónico mecanosensible es el TRPV4, que modula la señalización de Rho, siendo importante en la remodelación de la MT. También se ha afirmado que este canal juega un papel importante en la señalización de autofagia inducida por el estiramiento de las fibras de la MT.
También se ha descubierto que el óxido nítrico es fundamental en la señalización de la PIO. Se cree que su producción es inducida por el esfuerzo cortante en las células endoteliales del canal de Schlemm, lo que conlleva a la reducción de la resistencia hidráulica, facilitando el flujo del HA a través de los aspectos distales de la vía de drenaje. Por otro lado, los niveles de citoquinas también están relacionados con las propiedades biomecánicas de la MT, influyendo directamente en las fibras de actina que responden ante el estrés, la contractilidad celular y el incremento de deposición de proteínas fibróticas en la MEC. Finalmente, se ha descrito un rol vital en la vía de señalización Wnt, que también se asocia con cambios en la rigidez de la MT. De esta manera, al activar esta vía posterior a su inhibición, tendría un efecto protector frente al aumento de la PIO inducida por corticoides.
Con las premisas anteriores, las teorías modernas postulan que cualquier alteración en las vías de señalización anteriormente mencionadas podrían llevar a cambios en la PIO, lo que induciría alteraciones relacionadas con el glaucoma. Con esto, se sugiere que el microambiente celular, en el que se cuenta la rigidez de la MEC, influye en el comportamiento adaptativo o disruptivo de la MT. Ahora, hablando de la MEC, esta será motivo de una investigación exhaustiva debido a los comportamientos que se han observado en términos de los complejos de adhesión de la MEC en la MT. De esta manera, se podrá comprender mejor el papel de la MEC en la homeostasis biomecánica de la MT y su asociación con el flujo del HA.
El mayor entendimiento de todos los factores que influyen en las fuerzas biomecánicas que desencadenan el glaucoma permitirá, en el futuro, establecer blancos terapéuticos cuyo objetivo no sea disminuir la PIO, sino restablecer el balance biomecánico entre la PIO y las estructuras involucradas en la salida del HA y en la protección de las fibras nerviosas.
Adaptado de:
1. Safa BN, Wong CA, Ha J, Ethier CR. Glaucoma, and biomechanics. Vol. 33, Current Opinion in Ophthalmology. Lippincott Williams and Wilkins; 2022. p. 80–90.

Me gradué como Oftalmólogo en enero de 1980 en la Universidad de Cartagena, Colombia. Tengo claro desde entonces el papel de la malla trabecular en el desarrollo del glaucoma crónico simple o glaucoma primario de ángulo abierto. Por eso, no entiendo por qué se dejó de usar un aparato diagnóstico que medía el índice de salida del humor acuoso. Dicho de alguna manera, medía la función trabecular. Me refiero a la Tonografía Electrónica, aparato que, si no estoy mal, era producido por Laboratorios Alcon. Sugiero que se vuelva a considerar. No tengo ningún interés comercial, pues estoy dedicado a la Cirugía Plástica Ocular, pero creo que sería de gran utilidad para el pronóstico y tratamiento de los pacientes.