Docente Facultad Ciencias de la Salud
Universidad De La Salle
Editora del Área Condiciones de vida y Salud visual
El cerebro se interconecta con diversos órganos y sistemas, entre ellos el sistema visual. En efecto, diversas investigaciones postulan que el ojo es la prolongación más visible para evaluar el sistema nervioso central (SNC). (1) Por lo tanto, la consideración de que funciones las visuales y oculares puedan brindar información del estado cerebral cada vez coge más fuerza a tal punto que consensos mundiales en neurociencias comienzan a ver con buenos ojos el papel del profesional de la salud visual como parte del equipo interdisciplinar en el manejo de enfermedades neurodegenerativas como las enfermedades de Alzheimer y Parkinson, dos trastornos que según datos epidemiológicos, posterior a la pandemia COVID-19 han incrementado el número de casos.(2)
La enfermedad de Alzheimer (AD por sus siglas en ingles), es la principal causa de demencia senil y ha generado un gran número de afectaciones no solo en la calidad de vida de quien padece la enfermedad, sino un incremento en los costos en el sistema de salud, en la demanda laboral etc., por lo cual la emergencia de buscar estrategias de intervención rápida de la misma se hace inminente. (3)
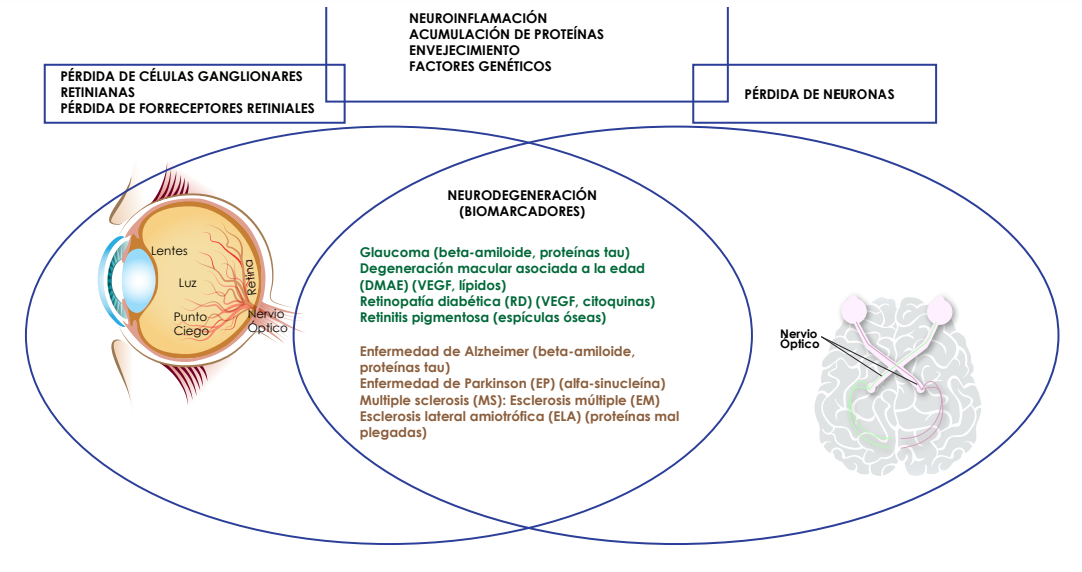
La AD, es una de las enfermedades neurodegenerativas más conocidas y algunos elementos biológicos hacen parte de su fisiopatología, como factores que conllevan a su desarrollo, entre ellos se describen la excitotoxicidad de glutamato, neuroinflamación, alteraciones en la autofagia y desregulación del sistema colinérgico.4,5 Interesantemente, algunos estudios ponen en evidencia que en el tejido retinal del adulto se presentan cambios neurodegenerativos similares al Alzheimer en enfermedades como el glaucoma, retinopatía diabética y degeneración macular asociada a la edad (DMAE), aspecto que a la hora de evaluar el estado neurodegenerativo se hace más accesible iniciar desde el ojo, específicamente la retina. (6)
Por ello, Wang & Mao (2021), describieron que, en estadios tempranos del Alzheimer, se detectan en distintas capas de la retina la presencia de péptido beta-amiloide y depósitos de proteína tau, dos biomarcadores del Alzheimer. (7) De igual manera, los hallazgos previamente mencionados se relacionan con la reducción del espesor de la capa de fibras nerviosas de las células ganglionares y cambios en funciones visuales tales como la sensibilidad al contraste, la visión al color y la percepción visual. (8-10)
Si se analizan los costos de los exámenes de apoyo para el diagnóstico del Alzheimer, se describen principalmente exámenes de neuroimagen como la resonancia magnética nuclear (RMN), PET (tomografía de emisión de positrones) y marcadores biológicos a partir de fluidos como líquido cefalorraquídeo (LCR), sangre etc., llevando a que en muchas ocasiones se limite el acceso a un diagnóstico asertivo. (11) Es en este punto, donde empieza a tomar un papel relevante el ojo, como ya se había descrito previamente, la retina es un “target” en el diagnóstico, y exámenes no invasivos para evaluar su anatomía y funcionalidad podrían arrojar datos en diagnóstico precoz del Alzheimer. Ver Figura 1.
Desde el punto de vista biológico, eventos como la desregulación del sistema colinérgico juega un papel importante no sólo en el desarrollo del Alzheimer sino en las manifestaciones clínicas de la enfermedad, como lo son la pérdida de memoria y los trastornos en la calidad del sueño. Curiosamente, el ojo vuelve a entrar a jugar un rol en este contexto: unas de las células de la retina regulan el ritmo circadiano y son las células ganglionares intrínsicamente fotosensibles (ipRGCs, en sus siglas en inglés) o también llamadas las células ganglionares que expresan melanopsina; la evidencia científica demuestra que dichas células llevan una valiosa información al núcleo supraquiasmático del hipotálamo y hacen parte de la maquinaria celular que regula el estado sueño/vigilia. (12) Por lo tanto, su impacto en la evaluación temprana toma vigor por varias razones: la primera, su menor invasividad a diferencia de pruebas como el análisis de biomarcadores a partir de LCR, la segunda: permite evaluar mediante el reflejo pupilar a la luz (RPL) la actividad nerviosa parasimpática, de manera especial la regulación colinérgica sobre la función visual y función cerebral. (13)
Esta segunda razón, se sugiere teniendo en cuenta que gran parte de la actividad colinérgica interviene en la actividad de dichas células y que, al ser un evento biológico en el Alzheimer, podría tener esa interconexión entre ojo y cerebro. Es así, como algunos artículos científicos recientes describen la importancia de las ipRGCs en el neurodiagnóstico.
Por otro lado, al hablar del sistema colinérgico, se debe mencionar el neurotransmisor (NT) que regula su funcionamiento: La acetilcolina, tiene un rol sobre el sistema visual. La evidencia demuestra que modula funciones en segmento anterior como la activación del sistema inmunológico a nivel corneal, la integridad de células caliciformes de la conjuntiva para expresar mucina e interesantemente, modula la respuesta lagrimal, favoreciendo la secreción de electrolitos y factores de crecimiento desde la glándula lagrimal. Desde ese punto de vista en el segmento posterior, la acetilcolina y sus receptores (muscarínicos y nicotínicos) se encuentran en células de la retina, en áreas de la corteza visual y núcleo geniculado lateral (NGL). Así mismo, algunos estudios en modelo animal refieren la interacción del sistema colinérgico con mediadores vasculares e inmunitarios en la retina y coroides. Todo lo anterior, demuestra una vez que es posible pensar en la evaluación del ojo como parte del diagnóstico y seguimiento de la enfermedad neurodegenerativa.
Otro tipo de enfermedad neurodegenerativa común es la enfermedad de Parkinson (EP), caracterizada principalmente por alteraciones en el control motor, donde manifestaciones tales como temblor, bradicinesia, rigidez muscular entre otras son las más descritas. Al hablar de la fisiopatología del Parkinson, se encuentra característicamente la participación de otro neurotransmisor: La dopamina, un NT que algunos autores lo describen como el NT de la felicidad. (13)
La interconexión entre el Parkinson y el ojo se articula con la presencia de la dopamina como modulador de diversas funciones visuales y oculares. Desde la función visual, se ha encontrado que en la actividad motora de los movimientos sacádicos y de seguimiento se requiere de adecuados niveles de dopamina y, en el Parkinson, los niveles de dopamina se encuentran reducidos, por lo cual la coordinación de los movimientos se ve afectada.15 Estudios mediante la tecnología del Eye-Tracker revelan que los movimientos sacádicos en individuos con la EP presentan dismetrías marcadas.

Por otra parte, el parpadeo es una función cortical que tiene como objetivo proteger las estructuras de la superficie ocular y, adicionalmente, permitir el movimiento adecuado de los lípidos de la película lagrimal para que estos sean distribuidos y con ello evitar la evaporación de la lágrima. En el caso de la EP, publicaciones recientes sugieren la inclusión de la evaluación del parpadeo. Es así, que autores como Iwaki et al., afirman que en individuos con Parkinson la frecuencia de parpadeo es reducida comparado con controles, (16) y esto lo confirman otras investigaciones donde revelan una baja amplitud y frecuencia de parpadeo en la EP y un incremento en la frecuencia de parpadeo en esquizofrenia, este último trastorno neurológico caracterizado por niveles elevados de dopamina. (17)
Conclusión
Cada vez toma fuerza que el ojo no es un órgano aislado y que éste tiene mucho que aportar en enfermedades generales, en este caso enfermedades neurodegenerativas y que en con concordancia con lo expuesto previamente, ciertas funciones visuales y oculares que en la consulta del profesional de la visión se evalúan de manera rutinaria podrían ser aplicables y obtener una valiosa información neurológica que ayudaría a reducir el número de pacientes diagnosticados tardíamente y por lo tanto generarían no solo dificultades en la vida diaria de quienes padecen la enfermedad y sus familiares sino en la sociedad en general, teniendo en cuenta los costos que se podrían optimizar al realizar un trabajo interdisciplinar en el abordaje de un paciente con Enfermedad neurodegenerativa.
Referencias
1 London, A.; Benhar, I.; Schwartz, M. The Retina as a Window to the Brain-from Eye Research to CNS Disorders. Nat. Rev. Neurol. 2013, 9 (1), 44–53. https://doi.org/10.1038/nrneurol.2012.227.
2 Li, C.; Liu, J.; Lin, J.; Shang, H. COVID-19 and Risk of Neurodegenerative Disorders: A Mendelian Randomization Study. Transl. Psychiatry 2022, 12 (1), 283. https://doi.org/10.1038/s41398-022-02052-3.
3 Tiwari, S.; Atluri, V.; Kaushik, A.; Yndart, A.; Nair, M. Alzheimer's Disease: Pathogenesis, Diagnostics, and Therapeutics. Int. J. Nanomedicine 2019, 14, 5541–5554. https://doi.org/10.2147/IJN.S200490.
4 Dong, X.; Wang, Y.; Qin, Z. Molecular Mechanisms of Excitotoxicity and Their Relevance to Pathogenesis of Neurodegenerative Diseases. Acta Pharmacol. Sin. 2009, 30 (4), 379–387. https://doi.org/10.1038/aps.2009.24.
5 Kocahan, S.; Doǧan, Z. Mechanisms of Alzheimer's Disease Pathogenesis and Prevention: The Brain, Neural Pathology, N-Methyl-D-Aspartate Receptors, Tau Protein and Other Risk Factors. Clinical Psychopharmacology and Neuroscience. 2017, pp 1–8. https://doi.org/10.9758/cpn.2017.15.1.1.
6 Marchesi, N.; Fahmideh, F.; Boschi, F.; Pascale, A.; Barbieri, A. Ocular Neurodegenerative Diseases: Interconnection between Retina and Cortical Areas. Cells 2021, 10 (9). https://doi.org/10.3390/cells10092394.
7 Wang, L.; Mao, X. Role of Retinal Amyloid-β in Neurodegenerative Diseases: Overlapping Mechanisms and Emerging Clinical Applications. Int. J. Mol. Sci. 2021, 22 (5). https://doi.org/10.3390/ijms22052360.
8 Lenoir, H.; Siéroff, É. Visual Perceptual Disorders in Alzheimer's Disease. Geriatrie et psychologie neuropsychiatrie du vieillissement. 2019, pp 307–316. https://doi.org/10.1684/pnv.2019.0815.
9 Risacher, S. L.; WuDunn, D.; Tallman, E. F.; West, J. D.; Gao, S.; Farlow, M. R.; Brosch, J. R.; Apostolova, L. G.; Saykin, A. J. Visual Contrast Sensitivity Is Associated with the Presence of Cerebral Amyloid and Tau Deposition. Brain Commun. 2020, 2 (1), fcaa019. https://doi.org/10.1093/braincomms/fcaa019.
10 Salobrar-García, E.; de Hoz, R.; Ramírez, A. I.; López-Cuenca, I.; Rojas, P.; Vazirani, R.; Amarante, C.; Yubero, R.; Gil, P.; Pinazo-Durán, M. D.; Salazar, J. J.; Ramírez, J. M. Changes in Visual Function and Retinal Structure in the Progression of Alzheimer's Disease. PLoS One 2019, 14 (8), e0220535. https://doi.org/10.1371/journal.pone.0220535.
11 Humpel, C.; Hochstrasser, T. Cerebrospinal Fluid and Blood Biomarkers in Alzheimer's Disease. World J. psychiatry 2011, 1 (1), 8–18. https://doi.org/10.5498/wjp.v1.i1.8.
12 Ostrin, L. A.; Abbott, K. S.; Queener, H. M. Attenuation of Short Wavelengths Alters Sleep and the IpRGC Pupil Response. Ophthalmic Physiol. Opt. 2017, 37 (4), 440–450. https://doi.org/10.1111/opo.12385.
13 Ahmadi, H.; Lund-Andersen, H.; Kolko, M.; Bach-Holm, D.; Alberti, M.; Ba-Ali, S. Melanopsin-Mediated Pupillary Light Reflex and Sleep Quality in Patients with Normal Tension Glaucoma. Acta Ophthalmol. 2020, 98 (1), 65–73. https://doi.org/10.1111/aos.14133.
14 Latif, S.; Jahangeer, M.; Maknoon Razia, D.; Ashiq, M.; Ghaffar, A.; Akram, M.; El Allam, A.; Bouyahya, A.; Garipova, L.; Ali Shariati, M.; Thiruvengadam, M.; Azam Ansari, M. Dopamine in Parkinson's Disease. Clin. Chim. Acta. 2021, 522, 114–126. https://doi.org/10.1016/j.cca.2021.08.009.
15 Shaikh, A. G.; Ghasia, F. F. Saccades in Parkinson's Disease: Hypometric, Slow, and Maladaptive. Prog. Brain Res. 2019, 249, 81–94. https://doi.org/10.1016/bs.pbr.2019.05.001.
16 Iwaki, H.; Sogo, H.; Morita, H.; Nishikawa, N.; Ando, R.; Miyaue, N.; Tada, S.; Yabe, H.; Nagai, M.; Nomoto, M. Using Spontaneous Eye-Blink Rates to Predict the Motor Status of Patients with Parkinson's Disease. Intern. Med. 2019, 58 (10), 1417–1421. https://doi.org/10.2169/internalmedicine.1960-18.
17 Mackert, A.; Flechtner, K. M.; Woyth, C.; Frick, K. Increased Blink Rates in Schizophrenics. Influences of Neuroleptics and Psychopathology. Schizophr. Res. 1991, 4 (1), 41–47. https://doi.org/10.1016/0920-9964(91)90008-f.