Cuando se contempla la opción de adaptar lentes de contacto (LC) en un paciente después de un trasplante corneal, se deben examinar cuidadosamente diferentes factores que influyen en el éxito del desempeño del lente. Entre estos se incluyen la salud del tejido trasplantado, tiempo transcurrido desde el trasplante, el estado visual, diseño a seleccionar, entre otros. Dada la complejidad de esta situación, Messer, Fosso, & Kuzniar (2023), publicaron un artículo que presenta una importante guía para la adaptación de LC en estos pacientes. Este artículo resalta la información proporcionada en dicha publicación, atendiendo a la apremiante necesidad de los profesionales de la salud visual de profundizar en este tema.
Consideraciones preliminares
Es crucial analizar la salud del trasplante y su capacidad potencial de tolerar el uso de LC. En este contexto, es prudente esperar y evaluar el tejido corneal trasplantado en un monitoreo frecuente entre 3 y 6 meses antes de considerar a este paciente como candidato. Durante este periodo, se monitorea también el tiempo adecuado para el retiro de suturas, considerando el astigmatismo e irregularidades corneales que suelen inducir en este procedimiento. A medida que se retiran progresivamente las suturas, se evalúa la reducción máxima del astigmatismo, hasta que la topografía, la refracción y la visión indiquen que el resultado final es manejable. Se ha observado que incluso sobre las suturas se puede adaptar un LC, siempre y cuando no se aplique presión sobre estas y no afecte la evolución del injerto.
Otro aspecto de gran relevancia para considerar es la salud de la superficie ocular. Después de un trasplante, el epitelio corneal puede estar debilitado y puede llevar tiempo reepitelizar toda la superficie. También puede ser vulnerable a generar erosiones o epiteliopatías persistentes que requieren un abordaje farmacológico y tratamiento previo o simultáneo a la adaptación de los LC. Además, se debe tener en cuenta que mientras esta barrera natural contra infecciones está debilitada, el riesgo de queratitis microbiana es constante. Por esta razón, la presencia de signos de alarma como edema corneal, inflamación activa, cicatrices u opacidades deben ser identificadas y monitoreadas oportunamente.
Ahora bien, una estructura que merece toda la atención clínica es el endotelio corneal. Por ejemplo, la presencia de córnea guttata podría ser una señal de alarma ante la posibilidad de rechazo del tejido a largo plazo; mientras que, si se observan precipitados retroqueráticos, se podría sospechar un rechazo activo en curso. Lo mismo aplicaría en el caso de observar vascularización, donde la extensión, grado de penetración y cobertura en la superficie corneal son signos altamente negativos sobre la salud del tejido trasplantado.
En cuanto a exámenes especiales de apoyo, el recuento basal de células endoteliales se vuelve imperativo. Por ejemplo, un trasplante que tiene un conteo de células endoteliales inferior a 800 células/mm² se considera de alto riesgo para edema corneal y un posible fallo del trasplante. En este contexto, se sugiere que un lente RGP de alta permeabilidad podría funcionar mejor que un lente de hidrogel o un escleral de espesor grueso, a menos que tenga túneles o fenestraciones que mejoren la oxigenación. En relación con el edema corneal, la paquimetría sería un soporte importante para su diagnóstico, seguimiento y evaluación del efecto del LC.
Entrando en el análisis de la morfología del trasplante, la topografía corneal y, si es posible, la perfilometría escleral se convierten en herramientas invaluables. Con estos equipos avanzados se puede realizar un análisis más preciso de las variables como la forma del injerto, la unión entre el injerto y el huésped, la unión corneo-escleral y la forma escleral. Un ejemplo claro es la diferencia de elevaciones que, al superar eventualmente las 350 µm, indicaría la selección de LC escleral. Por otro lado, al observar cicatrices conjuntivales, pterigión, pinguéculas, y dispositivos para drenaje de humor acuoso en glaucoma, se debe contemplar la posibilidad de utilizar otros diseños de lentes esclerales u optimizar la adaptación de RGP corneales. Ahora bien, si el paciente ya usaba LC y tenía confort con ellos, mantener el mismo tipo de lente puede contribuir a la tolerancia.
Diseño del lente de contacto
Antes de abordar los diseños de lentes recomendados, Messer, Fosso & Kuzniar (2023) sugieren obtener la autorización de un cirujano de córnea antes de proceder con la adaptación de los lentes. También es importante señalar que cuando el trasplante es de gran tamaño, la córnea tendrá una arquitectura topográfica sin mayores alteraciones, permitiendo el uso de LC blandos. Sin embargo, en muchos casos, será preferible optar por los lentes RGP. En este sentido, es crucial analizar la regularidad topográfica anterior de la córnea. Si esta regularidad está presente, la posición de un lente RGP corneal será estable. Por otro lado, si la irregularidad de la superficie es significativa, como en el caso de injertos protuberantes, inclinados o queratocono recurrente, probablemente se requeriría un lente RGP de diámetro más grande, como un diseño escleral, para obtener estabilidad posicional y visual.
Ahora es el momento de recalcar el uso de los lentes RGP corneales. Existe una alta probabilidad de utilizar diseños de geometría inversa para adaptarse mejor a la córnea empinada periféricamente en la unión entre el injerto y el huésped. De hecho, muchos laboratorios fabricantes distribuyen sets de prueba para casos de queratoplastia. Sin embargo, es posible que se realicen varias pruebas con diversos diseños hasta lograr una adecuada relación centroperiferia. Esto requerirá la selección de diferentes curvas base, tamaños, y diseños de cara posterior. Con esto se afirma que, dada la particularidad del caso y lo impredecible del resultado, no se espera encontrar un fluorograma estrictamente perfecto. Lo que se busca es lograr un alineamiento central o una claridad leve con fluoresceína, ya que el injerto central puede tener una forma algo hundida. En la zona de unión entre el injerto y el huésped, puede haber un ligero contacto, siendo lo importante es que no afecte el movimiento ni el intercambio lagrimal.
En términos generales, la zona de unión entre el injerto y el huésped es la más elevada, y es donde la córnea soportará el peso del lente RGP corneal. Durante la adaptación del lente, se busca encontrar un equilibrio entre la claridad central y el contacto en la zona de unión. Cuando este equilibrio falla, pueden formarse burbujas centrales o lesiones de tinción con morfología anular en la zona de unión. La adaptación correcta se logrará cuando la claridad central sea mínima y no se genere un efecto de adherencia del lente a la córnea, permitiendo así el ingreso y distribución normal de la lágrima. También es importante resaltar que cuando la superficie corneal es irregular, esto afectará directamente el centraje del lente, tendiendo a ubicarse en la región de mayor elevación corneal. Si el centraje no se logra fácilmente debido a la irregularidad de la córnea, se recomiendan diámetros grandes. Sin embargo, si el descentrado se produce por efecto del parpadeo, entonces un diámetro más pequeño puede ser la solución. Ver Figura 1.
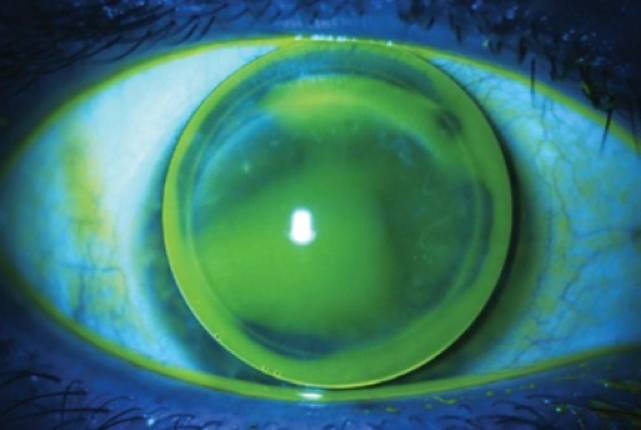
Aunque el lente RGP ofrece grandes beneficios, no se debe pasar por alto el riesgo de complicaciones en pacientes trasplantados como dellen, tinción corneal y separación de la unión injerto-huésped. Frente a estas complicaciones, es necesario ajustar los parámetros del lente e iniciar tratamiento con el lubricante adecuado. En caso de separación en la unión entre el injerto-huésped, el paciente debe ser remitido al cirujano de córnea y se debe suspender el uso del lente hasta obtener una autorización. Cuando los efectos de las complicaciones son graves y no se logra restablecer la salud de la superficie ocular y la visión, el lente escleral puede ser una opción viable para probar en el paciente.
Ahora, es el turno de los lentes esclerales. Estos se recomiendan cuando la irregularidad de la córnea es severa y compromete en gran medida la agudeza visual. La bóveda de interfaz líquida que se forma ayuda a neutralizar las irregularidades ópticas y permite un mayor confort, especialmente en casos de alteraciones severas de la superficie ocular. Una ventaja significativa para los pacientes trasplantados es que, al tener un menor movimiento y respetar la superficie corneal, se reducen los factores de fricción que, en un tejido tan vulnerable, podrían desencadenar una mayor cascada de inflamación.
Es fundamental resaltar que, para los pacientes post trasplante, el análisis de adaptación de lentes esclerales debe abordarse de manera personalizada debido a las condiciones específicas que, en cuanto a los signos clínicos, pueden cambiar de paciente a paciente en función de su metabolismo y su respuesta inmune. Los detalles del diseño del lente escleral estarán directamente relacionados con factores como el tamaño del botón corneal, la salud del injerto, la elevación central y periférica, la ubicación de la zona óptica, la presencia de suturas residuales, el estado refractivo y, como se mencionó antes, la ubicación de la zona de unión o transición entre el tejido corneal del injerto y el tejido corneal del huésped.
Aunque la adaptación personalizada se considera la mejor estrategia para el uso de lentes esclerales en estos pacientes, en términos generales se puede decir que existe una alta probabilidad de escoger un diseño oblato, debido a la geometría inversa propia del resultado quirúrgico. Esto disminuirá la profundidad sagital, evitando así bóvedas extensas que sobrepasen el espesor deseado. Sin embargo, esto no es una regla sine qua non, ya que, si el resultado postquirúrgico muestra un injerto prominente, podría requerir un diseño prolato para respetar la relación sagital y el tamaño de la bóveda.
Como se ha evidenciado, la adaptación de lentes esclerales representa mayores desafíos en trasplante corneal. Esto se debe a la atención minuciosa que requiere cada detalle del diseño. Por otro lado, existen complicaciones íntimamente relacionadas con la existencia del trasplante. Messer, Fosso, & Kuzniar (2023) indican que estos pacientes son propensos a desarrollar queratopatía bullosa epitelial. Estas bullas pueden generar un inconfort marcado y reducir la agudeza visual.
Adicionalmente, se relacionan con abrasiones o erosiones corneales que, en el peor de los casos, pueden ser persistentes. Las bullas epiteliales pueden surgir debido a un intercambio inadecuado de lágrimas bajo el lente, por un apoyo excesivo del lente sobre la córnea, un espacio excesivo sobre el injerto o succión. Ante esto, se requiere un cuidadoso proceso de readaptación.
Finalmente, para mantener la superficie ocular en homeostasis y reducir los riesgos de rechazo, los autores recomiendan proporcionar suficiente oxígeno a la córnea y evitar el edema corneal central. Un lente escleral no debe tener más de 250 μm de grosor, debe estar fabricado con el material de mayor Dk disponible, idealmente superior a 150 y debe ajustarse de manera que la bóveda no sea superior a 200 µm. En otros escenarios clínicos, se debe considerar la inclusión de fenestraciones o surcos para incrementar la oxigenación. Esta información puede ser de gran utilidad para los pacientes con trasplante de córnea que requieren adaptación de lentes de contacto. Ver Figura 2.
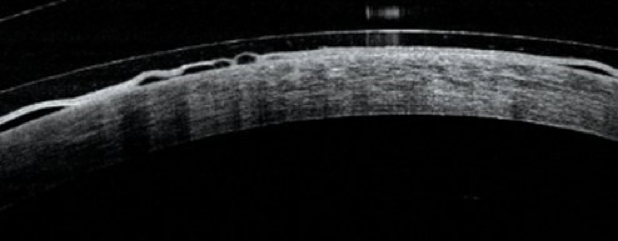
Este artículo es adaptado de: 1. Contact lens wear after corneal transplantation. Messer, Fosso, & Kuzniar. Contact Lens Spectrum, Volume: 38, Issue: October 2023, page(s): 34-36, 38, 40, 41.





20/20. Muy educativa, gracias.