En el síndrome de dispersión pigmentaria (SDP), existe un peligro constante en el sentido de que el pigmento disperso que se forma pueda llegar a acumularse en diferentes estructuras en la cámara anterior, y que eventualmente se constituya en un causante de aumento de la presión intraocular (PIO). ¿Qué relación existe entre el SDP y el glaucoma? Cabe resaltar que muchas veces el SDP no se diagnostica oportunamente, ya que sus manifestaciones clínicas son variadas, siendo en gran parte de los casos asintomático. Esto requiere una valoración angular más robusta. (1)(2)
Otro aspecto importante para tener en cuenta con el SDP, es la aparición de hipertensión ocular pigmentaria (HTOP). Se resalta que los hallazgos clínicos de esta entidad son similares a los que se presentan en la SDP. Lo diferencial en este caso es que cada aumento de 1 mmHg por encima de 21 mmHg, aumenta el riesgo 1.4 veces de desarrollar glaucoma pigmentario (GP). Las cifras muestran que esta entidad se presenta en mayor proporción en hombres, y que los adultos jóvenes son el grupo de mayor riesgo. Se ha descrito que, durante episodios agudos de dispersión de pigmento, la PIO puede variar hasta 8.08 mmHg en comparación con la PIO basal en los mismos individuos. Aquí cualquier síntoma como: dolor ocular, enrojecimiento, fotofobia y visión de halos alrededor de las luces cobra mayor necesidad de examinar el ojo a profundidad. (1)(3)
Cuando el GP aparece, también su frecuencia apunta en mayor grado hacia los hombres. Parece que un factor predictivo importante es una PIO > 21 mmHg, incluso cuando esta tiene fluctuaciones que pueden llegar a valores de 24.6 ± 4.0 mmHg en pacientes con SDP en episodios agudos. Hablando de los signos clínicos, aquellos individuos con GP tienen huso de Krukenberg más pronunciado relacionado con la lluvia de partículas de pigmentos que ocurren generalmente durante el ejercicio. También se ha descrito que existen episodios de ataques subagudos en los que se presenta edema corneal y disminución de la agudeza visual. Aunque la presencia de pigmento en el SDP no es un factor de riesgo definitivo o predictivo, cuando existe GP, la cantidad de pigmento definitivamente lo es en cuanto a la relación directamente proporcional entre la gravedad el GP y las manifestaciones del SDP. (1)(4)
Algo importante de resaltar es la relación que existe entre el GP y la miopía. En este sentido, se afirma que cuando existe un crecimiento rápido del globo ocular, se genera un espacio adicional para que el iris periférico se mueva hacia atrás. Este hecho promovería el desprendimiento de pigmento del iris, lo cual sería un factor predisponente para un inicio temprano de GP. También se establece que el contacto iridolenticular prolongado en ojos con SDP podría crear un mecanismo de válvula de bola donde el movimiento unidireccional del humor acuoso desde la cámara posterior hasta la cámara anterior resulta en una PIO aumentada a nivel de la cámara anterior con curvatura posterior del iris y cierre de la válvula del iris. (4)
Entrando en el terreno del diagnóstico, es preciso recordar la búsqueda de signos como el huso de Krukenberg y los defectos de transiluminación del iris. Este último, por ejemplo, se ha reportado que está presente en aproximadamente el 86 % de los pacientes en forma de defectos radiales, que deben diferenciarse de los defectos moteados en ojos normales con iris claros. (4) Ver Figura 1.
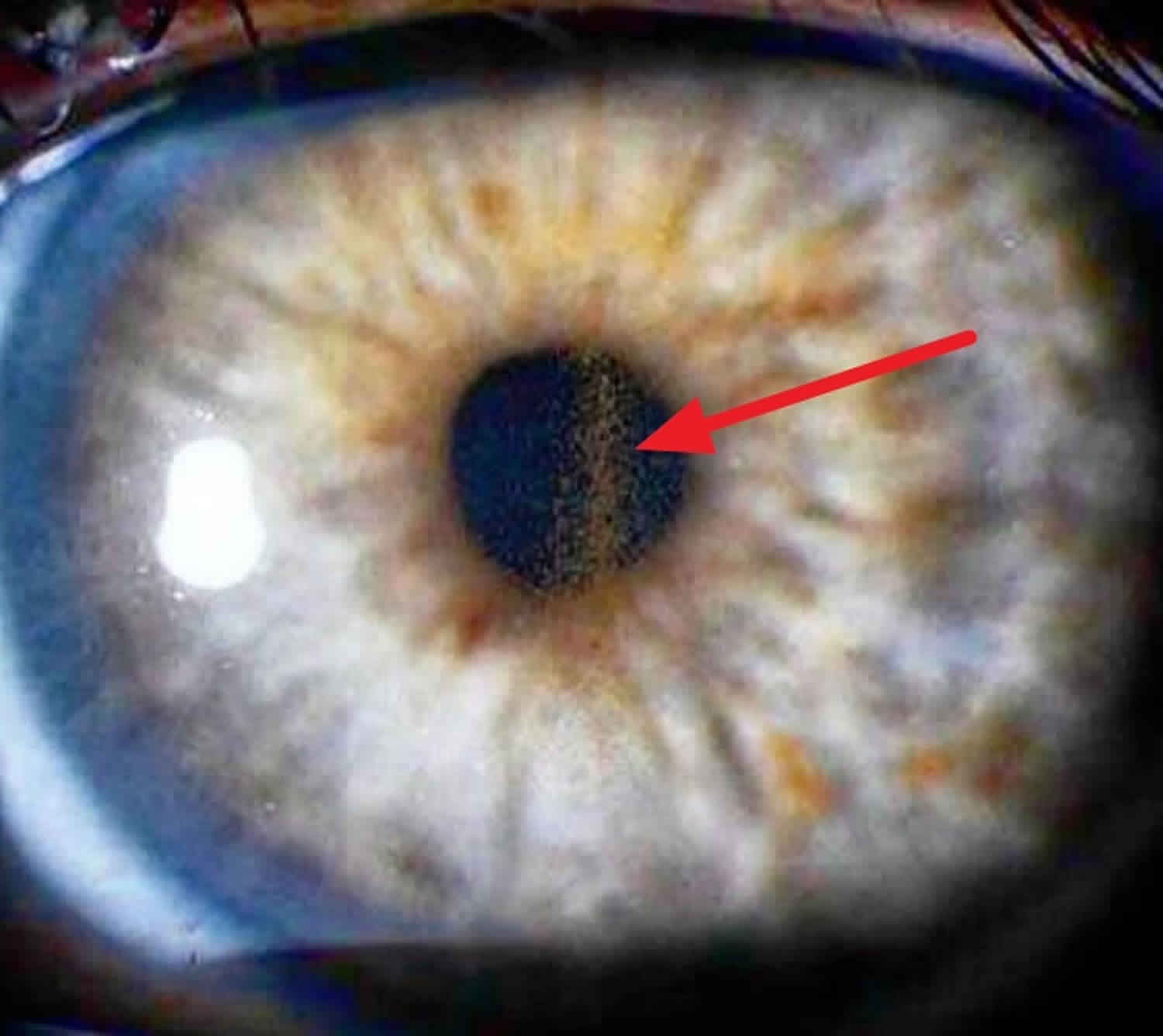
Figura 1. Huso de Krukenberg
La transiluminación del iris presenta un diseño característico de reflejos rojos en el fondo, similar a la ventana de la roseta de una iglesia, también conocido como el signo de vitral de iglesia. La asimetría en la transiluminación podría resultar en anisocoria, y se ha sugerido que esto podría ser causado por la irritación del iris debido a las zónulas o alteraciones en el músculo dilatador, lo cual es un aspecto importante para considerar durante procedimientos quirúrgicos en el segmento anterior. También es preciso retomar que los cambios en la excavación del nervio óptico, y los defectos en el campo visual apuntan al diagnóstico definitivo de GP. (4)
Por lo anterior, se recomienda que la campimetría se realice mediante el protocolo de evaluación SITA-SWAP (azul sobre amarillo), que es más sensible para detectar defectos campimétricos en el GP. Es importante notar que este tipo de glaucoma en ocasiones es más difícil de controlar que el glaucoma de ángulo abierto primario. Por lo tanto, el monitoreo de la PIO siempre deberá ser exhaustivo pacientes ya diagnosticados con GP y con HTOP. (1)
En cuanto a la progresión, la evolución de la GP generalmente entra en una etapa en la que la liberación de pigmento disminuye. Durante un período de 10 años, se observa una reducción en la dispersión del pigmento y la normalización de la PIO. Esta observación gonioscópica se denomina: “signo de reversión de pigmento”. En esta fase, la pigmentación en el ángulo inferior tiende a aclararse antes que la del ángulo superior, lo que resulta en una malla trabecular más oscura en la parte superior. Para identificar a los pacientes que están experimentando esta fase, la gonioscopía frecuente y el monitoreo regular de la PIO se convierten en pruebas fundamentales. En consecuencia, el reconocimiento del signo de reversión de pigmento puede ayudar a tomar decisiones sobre cuándo interrumpir la terapia antiglaucomatosa en caso de ser necesario. (1)
Para comprender finalmente la importancia que tiene identificar la delgada línea que divide al SDP del GP, se necesita tener en mente los siguientes factores de riesgo que pueden promover la conversión de SDP en GP: 1. Antecedentes familiares de glaucoma. 2. Pertenecer al sexo masculino. 3. Pacientes miopes con SDP y HTOP. 4. Pacientes con SDP que presentan huso de Krukenberg. 5. Evolución de 15 años de SDP sin diagnóstico, y 6. PIO inicial > 21 mmHg. (1)
Con respecto a las ayudas de apoyo diagnóstico en el GP, se destaca el rol que puede desempeñar la biomicroscopía ultrasónica (UBM), ya que permite una visualización detallada in vivo de las estructuras del segmento anterior. En el caso de pacientes con SDP, la UBM evalúa la relación entre el iris periférico y las estructuras zonulares en diferentes situaciones, como los reflejos pupilares, tanto a la luz como acomodativos, así como después del ejercicio. También se puede observar la indentación escleral a este nivel. (1) Ver Figura 2.
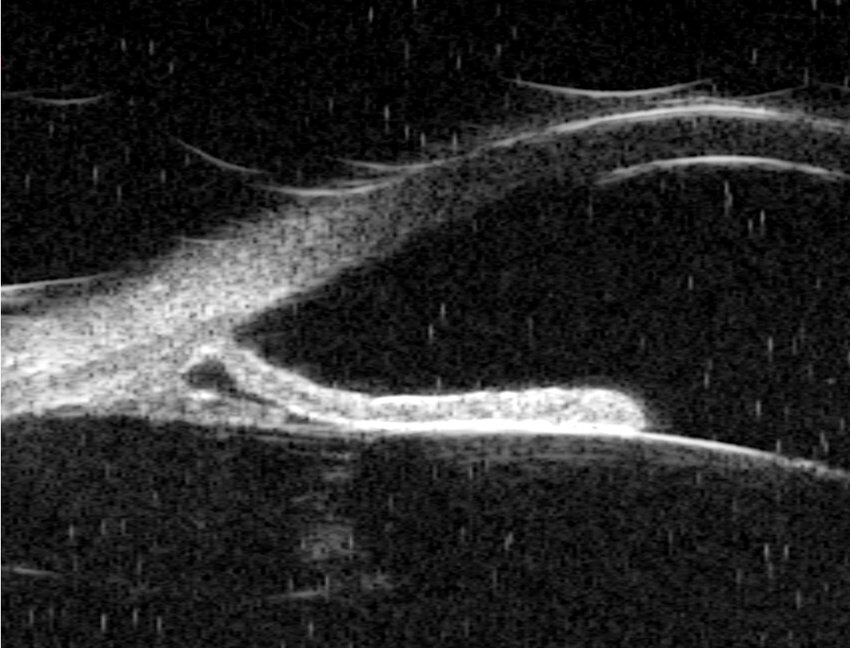
Figura 2. UBM en un paciente con SDP que muestra la concavidad del iris y el contacto irido-lenticular, su inserción posterior, y también el contacto con el cuerpo ciliar y las zónulas. (1)
Otro examen valioso es la tomografía de coherencia óptica (OCT) de segmento anterior (AS-OCT, por su sigla en inglés), que evalúa varias características en ojos con SDP, como la profundidad y ancho de la cámara anterior, diámetro pupilar, volumen y concavidad del iris. Estudios han demostrado que los ojos con SDP tienen un mayor volumen de la cámara anterior y área de contacto iridolenticular, así como una mayor relación volumen-longitud del iris en comparación con los casos controles. Las mediciones del espacio trabécula-iris fueron también significativamente mayores en ojos con SDP y GP. Por supuesto que como ya se ha mencionado, el protocolo de campo visual y análisis del nervio óptico y fibras nerviosas es imperativo en la confirmación de GO. (1)
El tratamiento del SDP y GP se basa en la etapa de la enfermedad, determinada por la actividad de dispersión de pigmento, la presencia de HTOP y el nivel de neuropatía glaucomatosa. El proceso natural de conversión de SDP a GP abarca tres fases críticas: la primera, una etapa activa de dispersión de pigmento, a menudo asintomática y desencadenada por factores como el ejercicio y el estrés emocional; la segunda fase implica el desarrollo de HTOP y daño al nervio óptico a medida que la región trabecular se satura de pigmento; por último, en la tercera fase, el pigmento comienza a eliminarse del trabeculado, la PIO se normaliza en algunos casos y los defectos en la transiluminación del iris disminuyen en prominencia. (1)
En cuanto al tratamiento del SDP y el GP, se sugiere el uso de pilocarpina para controlar la dispersión de pigmento. Además, se recomienda limitar la actividad física para prevenir la dispersión de pigmento, que puede ser desencadenada por el ejercicio. En lo que respecta a la iridotomía periférica con láser (IPL), ha generado opiniones controversiales, pero parece tener utilidad en ciertos pacientes con SDP. La IPL reduce la concavidad y curvatura hacia atrás del iris, generando un equilibrio de presión entre las cámaras anterior y posterior. Aunque reduce el contacto iridozonular y la liberación de pigmento, no corrige totalmente la concavidad del iris ni previene el daño de la trabécula. (1)
Como se mencionó anteriormente, la primera línea de enfoque en el tratamiento del GP es la terapia médica hipotensora. Sin embargo, las características particulares de los ojos con GP requieren una atención especial para considerar estrategias de tratamiento no médico. Fármacos colinérgicos como la pilocarpina tienen la ventaja de reducir la liberación de pigmento al contraer la pupila en miosis, disminuir el contacto iridozonular y bajar la PIO facilitando el flujo del humor acuoso. A pesar de estas ventajas teóricas, el uso de pilocarpina se ve limitado por su baja tolerancia, asociada con trastornos visuales vinculados a la miosis, enfermedades de la superficie ocular y el riesgo potencial de desgarros o desprendimientos de retina, especialmente en pacientes miopes. (1)
En la actualidad, se prefieren fármacos como los análogos de prostaglandinas, betabloqueadores y agonistas alfa. Cuando la terapia médica no logra alcanzar niveles aceptables de PIO, por lo general, la terapia con láser es suficiente para lograrlo. Por esta razón, la opción de utilizar terapia con láser se considera apropiada en el tratamiento del GP debido a la mayor absorción de energía por parte del pigmento en el trabeculado. Realizar gonioscopía para garantizar un ángulo abierto y cuantificar el pigmento la trabécula son requisitos esenciales. Tanto la trabeculoplastia con láser de argón como la trabeculoplastia selectiva con láser (TSL) son opciones viables, siendo la TSL preferida por su seguridad y capacidad de repetición. En lo concerniente a las cirugías mínimamente invasivas para el glaucoma (MIGS), estas representan un perfil de seguridad mejorado en comparación con la cirugía tradicional al evitar la formación de ampollas y desviar el humor acuoso hacia el canal de Schlemm. (1)
Se ha establecido entonces, que la complicación principal del SDP es el desarrollo de GP, una condición que puede ser grave para la función visual. Ambos comparten rasgos distintivos, como el contacto iridozonular y la dispersión de pigmentos en la cámara anterior, sugiriendo que podrían representar diferentes etapas de una misma condición en lugar de dos enfermedades independientes. Aunque los mecanismos subyacentes aún son desconocidos, se observa que los pacientes con GP tienen un mayor riesgo de experimentar aumentos en la PIO después de ciertos procedimientos láser, en comparación con pacientes con glaucoma primario de ángulo abierto GPAA o HTOP. Esto indica que frente a la sospecha de SDP, el paciente va a necesitar monitoreo frecuente y riguroso tanto del ángulo como de la PIO, identificando oportunamente la conversión de SDP a GP. (1)
Referencias
- Bustamante-Arias A, Ruiz-Lozano RE, Carlos Alvarez-Guzman J, Gonzalez-Godinez S, Rodriguez-Garcia A. Pigment dispersion syndrome and its implications for glaucoma. Vol. 66, Survey of Ophthalmology. Elsevier Inc.; 2021. p. 743–60.
- Zeppieri J. Pigment dispersion syndrome (PDS): A brief overview. Marco. Clin Transl Res. 2022.
- Tandon A, Zhang Z, Fingert JH, Kwon YH, Wang K, Alward WLM. The Heritability of Pigment Dispersion Syndrome and Pigmentary Glaucoma. Am J Ophthalmol. 2019 Jun 1; 202:55–61.
- Scuderi G, Contestabile MT, Scuderi L, Librando A, Fenicia V, Rahimi S. Pigment dispersion syndrome and pigmentary glaucoma: a review and update. Vol. 39, International Ophthalmology. Springer Netherlands; 2019. p. 1651–62.
Martín Edisson Giraldo Mendivelso. Optómetra ULS, Magister Ciencias de la Visión. ULS. Especialista en Segmento Anterior y Lentes de Contacto USTA, FELLOW IACLE. Profesor Universidad CES, Medellín. [email protected].





