Departamento Editorial de Franja Ocular
El glaucoma neovascular (GNV) es un tipo de glaucoma secundario que tiene el potencial de generar discapacidad visual severa debido a su mal pronóstico cuando la enfermedad evoluciona rápidamente. Los principales hallazgos clínicos de esta patología incluyen la neovascularización del iris y la formación de membrana neovascular en la malla trabecular. Se ha establecido que esta entidad corresponde al 5.8 % del total de pacientes con glaucoma de todos los tipos. A través del tiempo, este tipo de glaucoma ha sido denominado de diversas maneras: glaucoma hemorrágico, glaucoma trombótico, glaucoma congestivo, glaucoma rubeótico y glaucoma hemorrágico diabético. Aún se requiere consenso al respecto.1
En términos generales, el GNV se entiende como la elevación de la presión intraocular (PIO) relacionada con la formación de nuevos vasos y el crecimiento de tejido conectivo que afecta el sistema de drenaje del humor acuoso. Como se mencionó anteriormente, se trata de un glaucoma secundario proveniente de una gran variedad de patologías, donde el mecanismo desencadenante es la isquemia.2
En la patogénesis del GNV, se ha identificado que los eventos isquémicos retinales o la inflamación conllevan a su desarrollo. En este sentido, la hipoxia crónica conlleva a un desequilibrio de los factores relacionados con la angiogénesis que promueven la formación de nuevos vasos, la formación de membranas neovasculares y la extensión de estos fenómenos a la retina, el iris y el ángulo camerular. El factor promotor de angiogénesis más estudiado es el factor de crecimiento vascular endotelial (VEGF, por su sigla en inglés). Sin embargo, el factor de crecimiento transformador- β (TGF- β), y la interleuquina-6 (IL-6), entre otros, también se han identificado como importantes en el proceso de la neoformación vascular.2,3
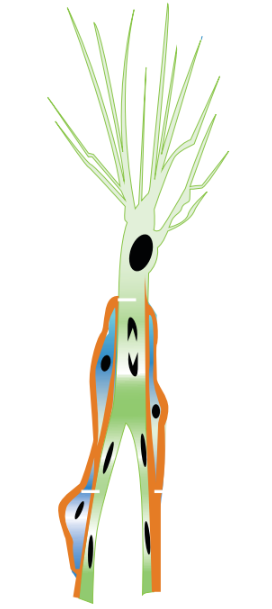
Figura 1. Durante la angiogénesis, se produce un proceso crucial conocido como diferenciación de células endoteliales. Los brotes angiogénicos se originan de un subgrupo de fenotipos especializados de células endoteliales (marcados en verde), cada uno con una función celular específica. Los pericitos de color azul son reclutados de manera inmediata para rodear el vaso sanguíneo en desarrollo y generar una lámina basal de color rojo.5
En el proceso de generación del GNV, se entiende que el desequilibrio de los factores VEGF, factor de crecimiento de hepatocitos, factor de crecimiento similar a la insulina-1 (IGF-1), factor de necrosis tumoral, TGF- β, trombospondina, y somatostatina juega un factor fundamental. Es necesario destacar al VEGF, el cual es liberado por diferentes tipos de células en la retina, entre las que se encuentran los pericitos, el epitelio pigmentario de la retina (EPR), el epitelio ciliar no pigmentado, las células de Müller y las células ganglionares.4
La razón por la cual se considera al VEGF como protagonista en la patogénesis del GNV radica en que es uno de los principales factores que afecta la permeabilidad vascular. Cuando se producen cantidades excesivas de VEGF, este se acumula en el polo posterior y migra hasta el polo anterior en la cámara anterior, induciendo el desarrollo de neovasos. Inicialmente, esta inducción afecta los capilares de los anillos arteriales mayor y menor del iris, luego a la cámara y, finalmente al ángulo camerular. La sobreexpresión de VEGF produce una ruptura de la barrera hematorretiniana, lo cual aumenta la adhesión de leucocitos en las células endoteliales. En el proceso, TGF- β y factores de crecimiento de fibroblastos, que posteriormente formarán las membranas fibrovasculares (MHV) cubriendo el iris y el ángulo.4
Dicha membrana, principalmente compuesta por miofibroblastos, es una estructura densa que causa obstrucción, impidiendo el drenaje del humor acuoso en la malla trabecular. De esta manera, todo estaría dispuesto para el GNV secundario de ángulo abierto. Pero esto puede cambiar; se ha descrito que MFV sufre cambios en términos de contracción, que finalmente cerrarán el ángulo, generando GNV secundario de ángulo cerrado. Es aquí donde las cosas van cada vez peor, porque se aumenta la PIO y se produce la neuropatía óptica.4
A profundidad con este proceso patogénico en el GNV, se conoce que el endotelio vascular libera enzimas proteolíticas, como las metaloproteinasas de matriz (MMPs). La expresión principalmente de MMP2, MMP-9, y MMP14 tienen un papel relevante en la angiogénesis. También es importante destacar que estas enzimas son responsables de la degradación de la membrana basal de los vasos sanguíneos cercanos. Este proceso conlleva a la formación de células de punta o de tallo a partir de las células endoteliales presentes en los vasos preexistentes. Se afirma que estas células con morfología especial facilitarían la formación de los nuevos vasos.5
Todavía se requiere evidencia para comprender el mecanismo de selección de estas células en punta y los factores que las inducen a proliferar, aunque se ha comprobado que el gradiente de VEGF ejerce influencia en esta dinámica. De este modo, las células endoteliales en punta se transforman en las células líderes en los extremos de los brotes vasculares y desempeñan un papel relevante en la evolución de la angiogénesis. Cuando existe un exceso de células en punta, los vasos sanguíneos recién formados mostrarán un patrón caótico.5
Por lo anterior, los vasos sanguíneos exhiben una apariencia distintiva en diversas condiciones de retinopatías proliferativas. En la formación del vaso, las células punta desempeñan un papel principal y jerárquico. Ahora bien, ahondando el tópico de las células punta, estas se caracterizan por la presencia de filopodios largos y polarizados, los cuales les permiten migrar en dirección a la matriz extracelular. Estas células también son capaces de detectar y responder a señales tanto de atracción como de repulsión que les sirven de guía en su desplazamiento.5 Ver Figura 1.
Dumbrăveanu, Cușnir, y Bobescu (2021) indican que todavía falta evidencia que explique el mecanismo de proliferación de estas células, las cuales no participan en la formación del lumen del vaso sanguíneo. Sin embargo, tienen la función de reclutar células no vasculares, como los pericitos. Las células endoteliales inmediatamente siguientes, a la célula punta, se diferencian en células del tallo. Las células del tallo pueden proliferar y promoverán la lumenogénesis. Lo que se sabe es que la célula punta tiene un fenotipo migratorio, atraída por el gradiente de VEGF, mientras que las células tallo son eminentemente proliferativas, por lo que se dividen formando las paredes que constituirán el nuevo vaso. Un tercer tipo celular, las células de la falange, mantienen la unión del nuevo capilar formado con el vaso de donde provienen. De esta manera, cuando dos capilares en crecimiento se encuentran, formarán un nuevo vaso capilar, que tendrá que ser estabilizado por el reclutamiento de pericitos y células de músculo liso vascular.5,6
La anastomosis de estos vasos es mediada por macrófagos residentes en el tejido. Es muy importante que el nuevo vaso esté cubierto por pericitos funcionales, ya que un reclutamiento defectuoso de estas células es perjudicial para los tejidos, especialmente para el ojo. Por lo tanto, el reclutamiento de pericitos se considera clave en la angiogénesis. Una vez que los neovasos suministran oxígeno y nutrientes, pueden entrar en un estado de reposo.5
Es tan crucial el papel del VEGF que no se puede olvidar que es una gran familia de proteínas y receptores, ya que, por ejemplo, favorecen la provisión de oxígeno y nutrientes a los tumores en desarrollo al incrementar su vascularización, lo que facilita su capacidad para hacer metástasis. Esta familia está compuesta por: VEGF-A, VEGF-B, VEGF-C, VEGF-D, VEGF-E y el Factor de Crecimiento Placentario (PlGF, por su sigla en inglés). En cuanto a VEGF-A, además de estimular la migración, mitosis de células endoteliales y la activación de las MMPs, y la integrina avb3, promueve la migración y proliferación de los astrocitos, contribuye a la formación del lumen vascular y genera fenestraciones en el tejido.5
El VEGF-A también es quimiotáctico para los macrófagos y los granulocitos, lo que contribuye de manera indirecta a la vasodilatación y al aumento del flujo sanguíneo. y también participa en la linfangiogénesis. La proteína VEGF-B es clave en el proceso de formación de nuevos vasos sanguíneos durante el desarrollo embrionario. El VEGF-C es importante en la linfangiogénesis. La proteína VEGF-D es fundamental en la formación de los vasos linfáticos en los bronquiolos pulmonares cercanos. VEGF-E fue identificado en el genoma del virus Orf. El PIGF es necesario en la formación de vasos sanguíneos y en el desarrollo de neovasos en hipoxia, así como en procesos inflamatorios, cicatrización de heridas y formación de nuevos tejidos.5
Así las cosas, cada variante del VEGF tiene la capacidad de unirse a uno o dos receptores específicos. Existen tres receptores a saber: VEGFR1, VEGFR2 y VEGFR3. Todos estos elementos son receptores de transmembrana de tipo tirosina quinasa. El VEGF-A se une tanto al receptor 1 del VEGFR1, codificado por el gen FLT1, como al receptor 2 VEGFR2, codificado por el gen KDR/FLK1. El VEGF-B se une exclusivamente al receptor VEGFR1. VEGF-C y VEGF-D son ligandos específicos de VEGFR3, el cual es codificado por el gen FLT4. Los anteriores se requieren en los procesos de angiogénesis embrionaria y linfangiogénesis. VEGF-C y VEGF-D, además de unirse a VEGFR2, tienen la capacidad de promover la formación de nuevos vasos sanguíneos, proceso conocido como angiogénesis. Durante la vasculogénesis embrionaria, es importante destacar que el VEGF-E se une específicamente al receptor de VEGFR2, mientras que el factor de crecimiento placentario (PlGF) se une exclusivamente al receptor VEGFR1.5
La activación de VEGFR2 es responsable de iniciar la mayoría de las respuestas celulares al VEGF. Los factores de crecimiento endotelial vascular tienen la capacidad de unirse a complejos receptores que consisten en una unión entre el VEGF y los VEGFRs, así como las neuropilinas. Las células endoteliales muestran una mayor intensidad de señalización para el VEGF a través de este receptor complejo. Las neuropilinas, conocidas como NRP-1 y NRP-2, son receptores de proteínas activas presentes en las neuronas, con la capacidad de regular procesos biológicos como la neurogénesis y la angiogénesis. Su función principal es la de actuar como correceptores, lo cual se debe a su naturaleza pleiotrópica.5
Durante la hipoxia retiniana, se produce un momento crítico en el cual se lleva a cabo la síntesis y eliminación del factor inducible por hipoxia (HIF-1 y HIF-2, por su sigla en inglés). Estos factores estimulan la expresión de diversas proteínas como el VEGF, el PDGF-B, el PIGF, el factor 1 derivado de células estromales (SDF1, por su sigla en inglés) con sus receptores y la angiopoyetina 2. Por lo anterior, ha surgido una nueva tendencia en el ámbito terapéutico que se enfoca en la inhibición de HIF-1 a través de técnicas de ingeniería genética y la inhibición de PDGF-B, respectivamente, como un objetivo terapéutico adicional.5
VEGF actúa como un agente quimiotáctico para las células en punta endoteliales. Los correceptores VEGFR2, VEGFR3 y NRP-1 están expresados en su superficie. Una vez que se encuentran, el ligando VEGF se une a sus receptores y activa las células punta. Luego, estas células expresarán el Delta-como ligando 4 (DLL4, por su sigla en inglés), codificado por el gen DLL4. Posteriormente, DLL4 se une como un ligando a los receptores Notch (Notch 1) en la superficie de las células del tallo endotelial que siguen a sus células en punta.5
La interacción DLL4-Notch resulta en el clivaje de la proteína Notch por una gamma-secretasa de la célula del tallo, liberando así un dominio intracelular de la proteína Notch (NICD). NICD reduce la expresión de VEGFR2, VEGFR3 y NRP1/2. Además, puede estimular la expresión de VEGFR1 en las células del tallo. Cuando VEGF se une a VEGFR1, se bloquea toda la vía de señalización de VEGF. Otro componente crítico es Jagged 1, que es una proteína codificada por el gen JAG1 con un papel importante en la señalización intercelular. Está altamente expresado en las células del tallo endotelial y actúa como un antagonista de DLL4, bloqueando la vía Notch. Debido a que la proteína Notch está presente tanto en las células punta como en las células del tallo endotelial, JAG1 también puede unirse al Notch de la célula punta, inactivando así la señalización.5
Los pericitos son células fundamentales para la viabilidad de los vasos sanguíneos recién formados. La migración de células endoteliales es facilitada por la expresión de proteasas y proteoglicanos en la punta del brote vascular. La promoción de la síntesis de MMPs, en particular la MMP 14, es facilitada por la interacción entre pericitos y células endoteliales, lo cual resulta fundamental para la estabilización de los neovasos. El reclutamiento de pericitos se encuentra bajo regulación de factores como el factor de crecimiento derivado de plaquetas tipo B (PDGF-B, por su sigla en inglés), las angiopoyetinas 1 y 2 (ANGPT1 y ANGPT2), y su receptor Tie2. La regulación de la angiogénesis, la adhesión de pericitos a la pared capilar y la estabilidad vascular son influenciadas por factores determinantes en este proceso. La elevada concentración de factores de crecimiento VEGF y ANGPT2 puede favorecer la inestabilidad de los vasos sanguíneos al promover la proliferación de células endoteliales y la activación de pericitos.5
Finalmente, en el ojo, diversas células como las células de Müller, el epitelio pigmentario de la retina, los pericitos de los capilares retinianos, las células endoteliales y ganglionares, y el epitelio no pigmentado del cuerpo ciliar, tienen la capacidad de segregar factores de crecimiento como el VEGF y el IGF-1, los cuales desempeñan un papel fundamental en el proceso de formación de nuevos vasos sanguíneos en el humor acuoso. En el contexto del glaucoma neovascular, el epitelio no pigmentado del cuerpo ciliar se identifica como una fuente primordial de VEGF, convirtiéndose en un blanco terapéutico relevante para el desarrollo de medicamentos en el futuro. Por lo tanto, es necesario tener una mayor comprensión de los procesos que conllevan a la formación de neovasos y sus consecuencias en la función visual.5
REFERENCIAS
- Lidder AK, Paranjpe V, Lauter AJ. Management of Neovascular Glaucoma [Internet]. Vol. 63, INTERNATIONAL OPHTHALMOLOGY CLINICS. 2023. Available from: www.internat-ophthalmology.com
- Senthil S, Dada T, Das T, Kaushik S, Puthuran G, Philip R, et al. Neovascular glaucoma-A review. Vol. 69, Indian Journal of Ophthalmology. Wolters Kluwer Medknow Publications; 2021. p. 525–34.
- Qiu M, Shukla AG, Sun CQ. Improving Outcomes in Neovascular Glaucoma. Vol. 5, Ophthalmology Glaucoma. American Academy of Ophthalmology; 2022. p. 125–7.
- Urbonavičiūtė D, Buteikienė D, Janulevičienė I. A Review of Neovascular Glaucoma: Etiology, Pathogenesis, Diagnosis, and Treatment. Vol. 58, Medicina (Lithuania). MDPI; 2022.
- A review of neovascular glaucoma. Etiopathogenesis and treatment. Rom J Ophthalmol. 2022 Jan 10;65(4).
- Núñez-Gómez E, Lopez-Novoa JM. Papel de endoglina en los eventos fisiológicos involucrados en la revascularización postisquémica. Angiologia. 2015 May;67(3):206–15.




