Introducción
La disfunción de las glándulas de Meibomio (DGM) es un desorden funcional, crónico, difuso, caracterizado por obstrucción del conducto terminal y/o cambios cualitativos-cuantitativos en la secreción glandular. Estos cambios pueden desencadenar una alteración de la película lagrimal, lo que provoca síntomas de irritación ocular e inflamación clínicamente aparente. (1-3) La inflamación crónica de las glándulas de Meibomio puede ocasionar enfermedad de la superficie ocular (ESO), siendo el trastorno más común el ojo seco hiperevaporativo (OSHE, por sus siglas en inglés). (4-6)
Los defectos epiteliales corneales persistentes (DECP) son un trastorno de la superficie ocular en el que los mecanismos de recuperación del epitelio corneal fallan, impidiendo la reepitelización del área dañada en el tiempo esperado, a pesar de seguir un tratamiento terapéutico. Estos defectos en el proceso de recuperación suelen estar relacionados con factores como trauma mecánico, ojo seco, queratopatía neurotrófica (QN), exposición a la luz ultravioleta, deficiencia de células madre del limbo y afecciones inflamatorias. Los lentes esclerales (LEs) han demostrado ser efectivos en el tratamiento de esta condición, favoreciendo la recuperación epitelial. (7–11) La disminución visual y el dolor pueden presentarse, por lo que el tratamiento debe ser oportuno, ya que podrían surgir complicaciones como opacidad corneal, queratitis infecciosa, ulcera corneal (UC), perforación corneal, entre otras. (7) La DECP puede ocurrir después de una queratoplastia penetrante (QP) por la toxicidad de los fármacos o la presencia de infecciones. (12)
La UC es considerada una emergencia oftalmológica caracterizada por un defecto epitelial que afecta al estroma subyacente y puede llevar a la perforación corneal si no se trata a tiempo. (13,14) Entre los factores que pueden causarla se incluyen infecciones crónicas de los anexos oculares, enfermedades subyacentes de la córnea, ojo seco (OS), QN por exposición, administración de agentes inmunosupresores tópicos o sistémicos y el empleo de lentes de contacto blandos de uso prolongado. (7,15) Los LEs han demostrado ser eficaces en el tratamiento de irregularidades de la córnea brindando una corrección visual insuperable (7,16–22) y en la ESO ofreciendo protección de la superficie e hidratación continua de la córnea. (7,16,27–30,17,18,20,22–26)
En cuanto al tratamiento de la superficie ocular el objetivo primordial es eliminar o disminuir los síntomas con su uso, tales como sensación de resequedad, dolor, irritación y fotofobia. (7,23,24,31,32)
El uso de suero autógeno (SA) como complemento de los LEs en la ESO proporciona, además de la hidratación corneal continua, factores de crecimiento que favorecen la recuperación epitelial; generalmente su uso se reserva para condiciones complejas. (33–38) La calidad de vida de los pacientes usuarios de LEs, especialmente aquellos que presentan ESO, mejora significativamente, como lo demuestran estudios que utilizan el cuestionario NEI-VFQ 25 (National Eye Institute Vision Functioning Questionnaire), donde se observa un aumento de los puntajes globales. (39–41)
En las córneas con queratoplastia (QTP) un factor importante en la contraindicación de un lente de contacto es la interacción que pueda surgir entre lente y epitelio corneal. Por esta razón, se sugiere el uso de un LEs, que no interactúa con la córnea. Sin embargo, es necesario supervisar el estado del endotelio corneal, (7,42) en una córnea quirúrgicamente tratada con OS DECP y UC, hay que evaluar el riesgo-beneficio, ya que estas condiciones podrían convertirse en la causa primaria de rechazo del injerto. La selección de un lente con alta transmisión de oxígeno (alto DK + espesor adecuado) y el control del clearance (separación entre córnea y lente ocupado por un tipo de solución) permiten mantener una adecuada fisiología, evitando un edema y, por consiguiente, una disminución de la visión. (8) (43–47)
El glaucoma también es una posible contraindicación para el uso de LEs ya que su asentamiento e interacción con estructuras como el canal de Schlemm, los canales de drenaje o venas epiesclerales podría ocasionar la elevación de la presión intraocular (PIO). Este efecto puede reducirse empleando LEs de diámetro grande que no interactúen con estas estructuras.42 El tratamiento farmacológico para el glaucoma puede producir OS, toxicidad epitelial e incluso descompensación del injerto. (48–5)
Reporte de caso
Un hombre de 45 años presenta intenso dolor en el ojo izquierdo (OI), acompañado de un DECP y UC de 2 mm de diámetro.
Historia previa:
2015: Se realiza QTP debido a una distrofia corneal no especificada y cirugía de catarata en ambos ojos (AO).
2018: Presenta una úlcera y DECP recurrente en OI, se dio manejo terapéutico con LC blando.
Julio 2019: Se diagnostica una UC y desepitelización en el OI (especialidad córnea), se maneja con tratamiento farmacológico con Moxifloxacino (antibiótico), Flusure (antinflamatorio) y Natutears (lubricante ocular).
Glaucoma AO (Especialidad Retina-Glaucoma), se maneja con: Azopt (inhibidor de la anhidrasa carbónica) y Timolol (betabloqueador).
Nov 2023: Reporta dolor leve y sensación de cuerpo extraño en OI, además refiere disminución de la visión en OI, desde septiembre 2019. También presenta triquiasis y Blefaritis AO.
Ene 2024: Presenta dolor moderado AO. Refiere ver solo sombras en OD desde diciembre 2019. Se observa descompensación corneal con presencia de bullas, leucoma y UC central de 2 mm en OD. Además, refiere pérdida progresiva de visión y presencia de úlcera temporal inferior (1mm) en OI. Se continua con tratamiento farmacológico AO.
Contactología Especializada Y Superficie Ocular
En junio del 2024, el paciente fue referido al área de Contactología especializada y Superficie Ocular debido a un dolor constante en el OD (leve) y OI (intenso). El objetivo del tratamiento era disminuir el dolor, favorecer la regeneración de tejido corneal y prevenir un posible rechazo del injerto a corto plazo.
Exámenes preliminares
En el examen con lámpara de hendidura se observó descompensación corneal con presencia de leucoma, DECP y UC de 2 mm de diámetro en el OI. (Ver Figura 1). El OD presenta desepitelización leve.
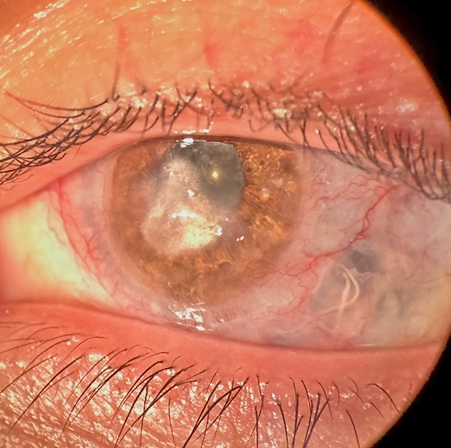
Figura 1. Leucoma, DECP y UC de 2 mm de diámetro en el OI.
La agudeza visual mejor corregida (AVMC) en el OI es percepción luminosa y en el OD 20/80 con campo visual reducido.
Para evaluar el estado de la superficie ocular se realizó una meibografía con el Keratograph, dando como resultados que el OD presenta DGM de 2° y en el OI DGM de 3°. Ver Figura 2a y 2b.
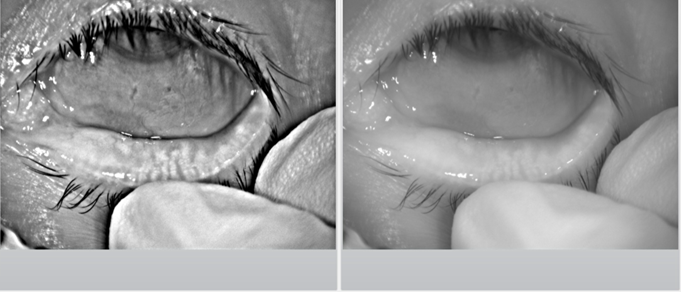
Figura 2a. Meibografía OI.
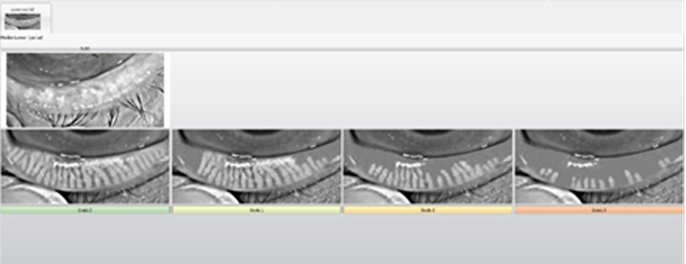
Figura 2b. Meibografía OI.
El tiempo de ruptura lagrimal no invasivo (TRLNI) da como resultado 0 segundos en el OI. (Ver Figura 3) y de 2 seg en el OD.

Figura 3. Tiempo de ruptura lagrimal no invasivo en OI.
El deterioro de la superficie corneal impidió realizar una topografía corneal con el Pentacam, así como una microscopia especular para determinar el estado del endotelio corneal.
Diagnóstico
Se puede observar la presencia de OSHE por DGM con la consiguiente DECP y UC. Posiblemente el uso crónico de medicamentos para el glaucoma también tenga implicancia sobre el DECP.
Manejo terapéutico
Se prescribió el uso de lentes esclerales (LEs) Maxim 3D en el OI. Después del proceso de adaptación, los parámetros se definieron de la siguiente manera:
- DIA: 18.2 mm
- CB: 44.00 D (5500 µm)
- Hápticas Tóricas (400µm/300 µm)
- DK: 180
- Tratamiento de Hydra-PEG™
Al regresar para la consulta de dispensación, se realizó la inserción del lente. Después de una hora se observó el lente centrado, con un apoyo escleral suave y un clearance bajo de aproximadamente 150 µm. (Ver Figura 4a, 4b y 4c).
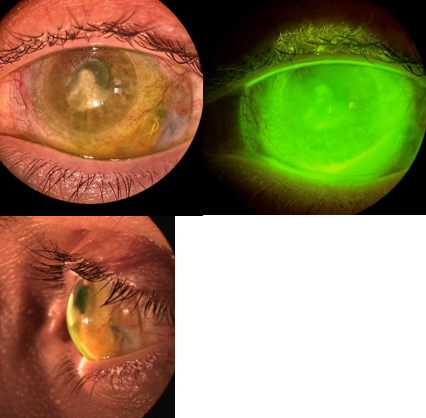
Figuras 4a, 4b y 4c. lente centrado, con un apoyo escleral suave y un clearance bajo de aproximadamente 150 µm.
El paciente reportó que el lente era confortable y, principalmente, que no se sentía dolor en el OI. El manejo terapéutico se complementó con suero autólogo para favorecer la reepitelización corneal.
Visita de control
Tres semanas después, en la visita de control, se observó un epitelio prácticamente recuperado y un paciente capaz de realizar sus actividades normalmente, algo que el dolor intenso no le permitía, incluso afectando su sueño nocturno. Ver Figura 5.
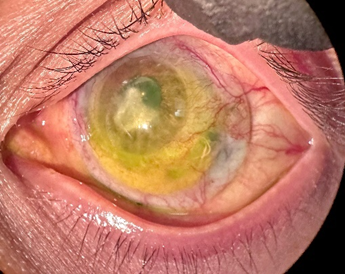
Figura 5. En el control, se observó un epitelio prácticamente recuperado en OI.
Conclusiones
El uso de los LEs es recomendado en el tratamiento de la ESO, con resultados favorables en la recuperación del epitelio corneal y en la atenuación o supresión de los síntomas como el dolor y la fotofobia. El suero autólogo se muestra como un complemento importante en el tratamiento de la DECP, acelerando el proceso de reepitelización de la córnea. Los pacientes con ESO que usan LEs experimentan un cambio positivo significativo, en su calidad de vida y su calidad visual, permitiéndoles recuperar la funcionalidad en diversas actividades dentro del ámbito laboral y social.
Referencias
- Daniel Nelson J, Shimazaki J, Benitez-del-Castillo JM, Craig J, McCulley JP, Den S, et al. The international workshop on meibomian gland dysfunction: Report of the definition and classification subcommittee. Investig Ophthalmol Vis Sci. 2011;52(4):1930–7.
- MacHalińska A, Zakrzewska A, Safranow K, Wiszniewska B, MacHaliński B. Risk Factors and Symptoms of Meibomian Gland Loss in a Healthy Population. J Ophthalmol. 2016;2016.
- Galor A. MGD: Definition Versus Dry Eye Disease, Risk Factors. Curr Ophthalmol Rep. 2014;2(2):58–64.
- Thia ZZ, Tong L. Update on the role of impression cytology in ocular surface disease. Taiwan J Ophthalmol [Internet]. 2019 Jul 1 [cited 2020 Dec 2];9(3):141–9. Available from: /pmc/articles/PMC6759557/?report=abstract
- Siak JJK, Tong L, Wong WL, Cajucom-Uy H, Rosman M, Saw SM, et al. Prevalence and Risk Factors of Meibomian Gland Dysfunction: The Singapore Malay Eye Study. Cornea [Internet]. 2012 Nov [cited 2020 Dec 2];31(11):1223–8. Available from: http://journals.lww.com/00003226-201211000-00002
- Tan LL, Morgan P, Cai ZQ, Straughan RA. Prevalence of and risk factors for symptomatic dry eye disease in Singapore. Clin Exp Optom. 2015;98(1):45–53.
- Harthan JS, Shorter E. Therapeutic uses of scleral contact lenses for ocular surface disease: Patient selection and special considerations. Clin Optom. 2018;10:65–74.
- Khan M, Manuel K, Vegas B, Yadav S, Hemmati R, Al-Mohtaseb Z. Case series: Extended wear of rigid gas permeable scleral contact lenses for the treatment of persistent corneal epithelial defects. Contact Lens Anterior Eye [Internet]. 2019;42(1):117–22. Available from: https://doi.org/10.1016/j.clae.2018.09.004
- He X, Donaldson KE, Perez VL, Sotomayor P. Case Series: Overnight Wear of Scleral Lens for Persistent Epithelial Defects. Optom Vis Sci [Internet]. 2018 Jan 1 [cited 2020 Nov 29];95(1):70–5. Available from: http://journals.lww.com/00006324-201801000-00010
- Rosenthal P, Cotter JM, Baum J. Treatment of persistent corneal epithelial defect with extended wear of a fluid-ventilated gas-permeable scleral contact lens. Am J Ophthalmol. 2000;130(1):33–41.
- Ciralsky JB, Chapman KO, Rosenblatt MI, Sood P, Fernandez AGA, Lee MN, et al. Treatment of refractory persistent corneal epithelial defects: A standardized approach using continuous wear PROSE therapy. Ocul Immunol Inflamm. 2015;23(3):219–24.
- Hos D, Matthaei M, Bock F, Maruyama K, Notara M, Clahsen T, et al. Immune reactions after modern lamellar (DALK, DSAEK, DMEK) versus conventional penetrating corneal transplantation. Prog Retin Eye Res [Internet]. 2019;73(December 2018):100768. Available from: https://doi.org/10.1016/j.preteyeres.2019.07.001
- Ahmed F, House RJ, Feldman BH. Corneal Abrasions and Corneal Foreign Bodies. Prim Care – Clin Off Pract [Internet]. 2015;42(3):363–75. Available from: http://dx.doi.org/10.1016/j.pop.2015.05.004
- Amescua G, Miller D, Alfonso EC. What is causing the corneal ulcer Management strategies for unresponsive corneal ulceration. Eye [Internet]. 2012;26(2):228–36. Available from: http://dx.doi.org/10.1038/eye.2011.316
- Revisi CDE, Rosa B, Garcel B, Arafet AT, Mograbe S, Rodr EM, et al. Algunas consideraciones actuales sobre las úlceras corneales Some current considerations on corneal ulcers. Medisan [Internet]. 2012;16(11):1773–83. Available from: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1029-30192012001100016&lng=es
- Dimit R, Gire A, Pflugfelder SC, Bergmanson JPG. Patient ocular conditions and clinical outcomes using a PROSE scleral device. Contact Lens Anterior Eye. 2013 Aug 1;36(4):159–63.
- Parra AS, Roth BM, Nguyen TM, Wang L, Pflugfelder SC, Al-Mohtaseb Z. Assessment of the Prosthetic Replacement of Ocular Surface Ecosystem (PROSE) scleral lens on visual acuity for corneal irregularity and ocular surface disease. Ocul Surf. 2018 Apr 1;16(2):254–8.
- Gelles JD. Specialty Lenses for Irregular Cornea and Ocular Surface Disease. Contact Lens Spectr [Internet]. 2020;35(2):20–5. Available from: https://bt.e-ditionsbyfry.com/publication/frame.php?i=648110&p=&pn=&ver=html5
- Schornack M, Nau C, Nau A, Harthan J, Fogt J, Shorter E. Visual and physiological outcomes of scleral lens wear. Contact Lens Anterior Eye. 2019 Feb 1;42(1):3–8.
- Jones L, Downie LE, Korb D, Benitez-del-castillo JM, Dana R, Deng SX, et al. The Ocular Surface TFOS DEWS II Management and Therapy Report. Ocul Surf [Internet]. 2017;15(3):575–628. Available from: http://dx.doi.org/10.1016/j.jtos.2017.05.006
- Ozek D, Kemer OE, Altiaylik P. Visual performance of scleral lenses and their impact on quality of life in patients with irregular corneas. Arq Bras Oftalmol [Internet]. 2018 Nov 1 [cited 2020 Nov 15];81(6):475–80. Available from: https://pubmed.ncbi.nlm.nih.gov/30231157/
- C AP, Joshi P, Umesh Y. Clinical Applications and Therapeutic Outcomes of Scleral Contact Lenses- A Retrospective Study. 2018;8(February):60–6.
- Romero-Rangel T, Stavrou P, Cotter J, Rosenthal P, Baltatzis S, Foster CS. Gas-permeable scleral contact lens therapy in ocular surface disease. Am J Ophthalmol. 2000;130(1):25–32.
- Rosenthal P, Croteau A. Fluid-Ventilated, Gas-Permeable Scleral Contact Lens Is an Effective Option for Managing Severe Ocular Surface Disease and Many Corneal Disorders That Would Otherwise Require Penetrating Keratoplasty. Eye Contact Lens Sci Clin Pract [Internet]. 2005 May [cited 2020 Dec 1];31(3):130–4. Available from: http://journals.lww.com/00140068-200505000-00009
- Ashraf R, Ranjakumar TC, Sundaram L, Swaminathan S, Hassan SA. New Therapy for Ocular Surface Disorders on the Horizon – Prosthetic Replacement of the Ocular Surface Ecosystem : A Review Article. 2015;3(8):178–81.
- Fadel D, Barnett M. Ocular Surface Disease in Sjögren’s Syndrome: Management in a Scleral Lens Clinical Practice. J Contact lens Res Sci. 2020;4(1):e12–22.
- Schornack MM, Pyle J, Patel S V. Scleral lenses in the management of ocular surface disease. Ophthalmology [Internet]. 2014;121(7):1398–405. Available from: http://dx.doi.org/10.1016/j.ophtha.2014.01.028
- Thulasi P, Djalilian AR. Update in Current Diagnostics and Therapeutics of Dry Eye Disease. Ophthalmology [Internet]. 2017 Nov 1 [cited 2020 Nov 15];124(11):S27–33. Available from: https://pubmed.ncbi.nlm.nih.gov/29055359/
- Schornack MM. Scleral Lenses A Literature Review. Eye Contact Lens Sci Clin Pract [Internet]. 2015 Jan 13 [cited 2020 Dec 1];41(1):3–11. Available from: http://journals.lww.com/00140068-201501000-00002
- Barnett OD Melissa A F. 10 tips to enhance SCLERAL CONTACT LENS SUCCESS. Optom Times [Internet]. 2017;9(7):1,15-16,18,20. Available from: https://search.proquest.com/docview/1923716301?accountid=50433
- Visser ES, Visser R, Van Lier HJJ, Otten HM. Modern scleral lens’s part I: Clinical features. Eye Contact Lens. 2007;33(1):13–20.
- Visser ES. Objective and subjective performance of scleral lenses and new advances in scleral lens technologies [Internet]. 2015. 1–189 p. Available from: https://dspace.library.uu.nl/handle/1874/322813
- Geerling G, MacLennan S, Hartwig D. Autologous serum eye drops for ocular surface disorders. Br J Ophthalmol. 2004;88(11):1467–74.
- McGinty-Tauren MB, Cornelius M. Autologous, Allogeneic and PRP: The Many Facets of Serum Tears [Internet]. Review of Cornea & Contact Lenses. 2020 [cited 2020 Nov 29]. Available from: https://www.reviewofcontactlenses.com/article/autologous-allogeneic-and-prp-the-many-facets-of-serum-tears
- Ma I-H, Chen L, Tu W-H, Lu C-J, Huang C-J, Chen W-L. Serum components and clinical efficacies of autologous serum eye drops in dry eye patients with active and inactive Sjogren syndrome. Taiwan J Ophthalmol [Internet]. 2017 Oct 1 [cited 2020 Nov 29];7(4):213. Available from: http://www.e-tjo.org/text.asp?2017/7/4/213/218990
- Quinto GG, Campos M, Behrens A. Autologous serum for ocular surface diseases. Arq Bras Oftalmol. 2009;71(6 SUPP):47–54.
- Discussion C. Clinical Commissioning Policy Statement Serum eye drops for the treatment of severe ocular surface disease (all ages) [200403P] Commissioning Position [Internet]. NHS England 2020 p. 1–11. Available from: https://www.england.nhs.uk/publication/serum-eye-drops-for-the-treatment-of-severe-ocular-surface-disease-all-ages/
- Franchini M, Cruciani M, Mengoli C, Marano G, Capuzzo E, Pati I, et al. Serum eye drops for the treatment of ocular surface diseases: A systematic review and meta-analysis. Blood Transfus. 2019;17(3):200–9.
- Picot C, Gauthier AS, Campolmi N, Delbosc B. Qualité de vie des patients équipés en verres scléraux. J Fr Ophtalmol. 2015 Sep 1;38(7):615–9.
- Bhattacharya P, Mahadevan R. Quality of life and handling experience with the PROSE device: an Indian scenario. Clin Exp Optom. 2017;100(6):710–7.
- Baali M, Belghmaidi S, Ahammou H, Belgadi S, Hajji I, Moutaouakil A. Évaluation de la qualité de vie des patients équipés en verres scléraux à l’aide d’une version marocaine du NEI-VFQ 25. J Fr Ophtalmol. 2018 Mar 1;41(3):201–5.
- Fadel D, Kramer E. Potential contraindications to scleral lens wear. Contact Lens Anterior Eye. 2019 Feb 1;42(1):92–103.
- Fadel D. Scleral Lens Issues and Complications Related to a Non-optimal Fitting Relationship Between the Lens and Ocular Surface. Eye Contact Lens Sci Clin Pract [Internet]. 2019 May 1 [cited 2020 Nov 15];45(3):152–63. Available from: http://journals.lww.com/00140068-201905000-00002
- Tan B, Tse V, Kim YH, Lin K, Zhou Y, Lin MC. Effects of scleral-lens oxygen transmissibility on corneal thickness: A pilot study. Contact Lens Anterior Eye. 2019;42(4):366–72.
- Compañ V, Oliveira C, Aguilella-Arzo M, Moll´a S, Peixoto-de-Matos SC, Gonz´alez-M´eijome JM. Oxygen diffusion and edema with modern scleral rigid gas permeable contact lenses. Investig Ophthalmol Vis Sci. 2014;55(10):6421–9.
- Jaynes JM, Edrington TB, Weissman BA. Predicting scleral GP lens entrapped tear layer oxygen tensions. Contact Lens Anterior Eye [Internet]. 2015 Feb 1 [cited 2020 Nov 15];38(1):44–7.
Available from: http://www.contactlensjournal.com/article/S1367048414001143/fulltext
- Michaud L, van der Worp E, Brazeau D, Warde R, Giasson CJ. Predicting estimates of oxygen transmissibility for scleral lenses. Contact Lens Anterior Eye [Internet]. 2012 Dec [cited 2020 Nov 15];35(6):266–71. Available from: https://pubmed.ncbi.nlm.nih.gov/22878418/
- Baltaziak M, Chew HF, Podbielski DW, Ahmed IIK. Glaucoma after corneal replacement. Surv Ophthalmol [Internet]. 2018;63(2):135–48. Available from: https://doi.org/10.1016/j.survophthal.2017.09.003
- Tokuda N, Kitaoka Y, Matsuzawa A, Miyamoto J, Sakae S, Munemasa Y, et al. The effect of rebamipide on ocular surface disorders induced by latanoprost and timolol in glaucoma patients. J Ophthalmol. 2015;2015:1–6.
- Hashimoto Y, Kitamoto K, Aihara M, Usui T. Toxicity profiles of fixed-combination eye drop for glaucoma therapy using cultivated human corneal epithelial sheets. Jpn J Ophthalmol [Internet]. 2020;64(3):304–11. Available from: https://doi.org/10.1007/s10384-020-00742-3

Autor: Edward Carmona OD, MSc, FSLS, NCLE-AC.






Excelente el poder leer estos casos de pacientes, que con una adaptación de un profesional capacitado le da un giro a su calidad de vida y comodidad visual de 180’. Estos casos inspiran a seguir aprendiendo y capacitándome para poder cambiar vidas como lo hace el Doctor Carmona.