A pesar de los avances en la medicina, se sabe que la diabetes sigue en ascenso a nivel mundial y la OMS estima que para el 2030 se van a tener más de 350 millones de personas con retinopatía diabética y, de estos, casi la mitad van a presentar edema macular diabético (EMD), que como se conoce, es la causa principal de la disminución de la visión en la población activa laboral. Este se presenta en pacientes que, por lo general, se van a encontrar entre los 40 y 55 años de edad. También se estima que para el 2030, se va a duplicar la prevalencia del edema macular diabético, y la incidencia en pacientes diabéticos, que han convivido más de 20 años con la enfermedad, que es de más o menos un 30%. (1)
En el edema macular diabético clínicamente significativo se puede ver un engrosamiento de la mácula, asociado a exudados duros, tanto en el centro, como excéntricos a la fóvea. A nivel de la tomografía se va a encontrar la presencia de quistes, engrosamiento del centro foveal a nivel macular y dependiendo de la severidad, se puede encontrar hasta líquido subrretiniano.
TEORÍAS FISIOPATOLÓGICAS (2,3)
Hay muchas teorías con respecto a la fisiopatología de la enfermedad, pero las principales cinco teorías más avaladas por la comunidad de retinólogos, son: leucostasis, estrés oxidativo, hipoxia/pérdida de pericitos, engrosamientos de la membrana basal/debilitamiento de uniones adherentes e inflamación crónica. De las cuales las primeras tres leucostasis, estrés oxidativo y la hipoxia se van a catalogar dentro de las teorías vasogénicas, donde hay problemas de la cir culación, salida de radicales libres al espacio retiniano y entre las capas de la retina, mientras que al mismo tiempo hay hipoxia por el daño directo de los capilares de la retina que van a producir microinfartos y a generar EMD. La inflamación crónica y el engrosamiento de la membrana basal al mismo tiempo que el debilitamiento de las uniones adherentes, se consideran dentro de las teorías citotóxicas.
TRATAMIENTO ACTUAL (4,5,6)
Luego del advenimiento de los antiangiogénicos, se pasó de tratar los edemas maculares diabéticos con láser a tratarlos con inyecciones intravítreas y desde finales de la última década de los 2000 a la fecha, se vienen utilizando los mismos tres antiangiogénicos que se han utilizado por más de 10 años. Si bien es cierto que todos van muy de la mano, hay ciertos estudios que le dan una mayor eficacia en ciertas condiciones muy específicas al aflibercept, pero en conceptos generales no hay una diferencia tan importante entre un medicamento y otro. Lo que sí ha venido cambiando de manera significativa es la imagenología que sirve para el diagnóstico del EMD, con el advenimiento de mejores cámaras de fotografía del fondo, mejores imágenes de las angiografías con fluoresceína e incluso el advenimiento también de la tomografía de coherencia óptica (OCT) y de la angiografía guiada por tomografía de coherencia óptica, que viene a jugar un rol muy importante en el manejo y pronóstico de esta entidad.
BIOMARCADORES
Se tienen principalmente seis biomarcadores: severidad de los espacios quísticos, puntos hiperreflectivos, niveles intraoculares de citoquinas, grado de isquemia macular, disrupción de la zona elipsoide (ZE) y la desorganización de capas retinianas internas (DRIL por su sigla en inglés). Estos van a hablar de un buen o mal pronóstico a la hora de valorar en un paciente la presencia de un EMD.
Severidad de los espacios quísticos: Pelosini y colaboradores hicieron un estudio de EMD donde veían y evaluaban el tejido residual entre los quistes del EMD y, específicamente en este caso, se referían a las células de Muller. Encontraron que la agudeza visual era dependiente de qué tanto tejido había entre las capas plexiformes, de si el EMD presentaba un aumento por encima de las 500 micras y si los quistes eran mayores de 500 micras o no, ya que ellos teorizan que hay un daño directo a las células bipolares, que presentan mayor concentración a nivel foveal y, por lo tanto, por encima de estas 500 micras, ellos estipulan que hay un daño probablemente irreversible de la agudeza visual. (7)
Puntos híperreflectivos: los famosos hyperreflective dots, descritos ya hace un buen tiempo, todavía no se sabe del todo qué son, pero se entiende que pueden ser precursores de exudados duros, como material lipídico o, según algunas teorías que avalan el hecho de que son depósitos de material inflamatorio. La verdad, no está del todo claro sí es un biomarcador de buen o mal pronóstico, pero sí se sabe que cuando hay presencia de puntos hiperreactivos, por lo general los pacientes tienden a responder mejor al tratamiento con antiangiogénicos. (8)(9)
Niveles intraoculares de factores inflamatorios: juegan un rol bien importante principalmente en la resolución del EMD, se sabe que, por lo general, en estadios iniciales de esta enfermedad, se va a ver caracterizado por un componente primordialmente vascular. Hay un daño directo al endotelio y por lo tanto habrá una extravasación del líquido hacia los espacios intercapilares. Sin embargo, con el paso de la enfermedad se ha visto que hay un rol mucho más importante en los factores proinflamatorios como el VEFG, ICAM 1 y las interleuquinas 6 y 10. Por lo tanto, en los estadios más crónicos de la enfermedad esto juega un rol importante, principalmente para tratar de resolver la presencia del líquido, tanto intra como subrretinal. (10) (11)
El grado de isquemia macular: es un factor de muy mal pronóstico si está afectada el área foveal avascular, la mácula central. Se sabe de este biomarcador desde la época de la angiografía convencional, pero con el advenimiento de la OCT-A, se tiene un estudio más confiable para determinar tanto la presencia de la isquemia macular como la extensión real del área de isquemia y, por lo tanto, cuando se diagnostica una isquemia macular, es conveniente simplemente cesar el tratamiento, porque se sabe que no habrá mejoría visual a pesar de que se resuelva el EMD. (12)
Disrupción de la ZE: se sabe que estas líneas hiperreflectivas externas comprendidas entre la membrana limitante externa, la zona elipsoide y el EPR son de suma importancia para la mejoría de la agudeza visual, luego de resuelto el edema. Principalmente porque se está en área de fotorreceptores, entonces una vez que hay un daño principalmente en la zona foveal de estas líneas externas, se puede asegurar que va haber un daño inminente y probablemente irreversible, si a través del tiempo, no hay una reestructuración de la misma. La membrana limitante externa por lo general sirve de soporte para las líneas más externas principalmente la zona elipsoide y, por lo tanto, cuando falta la limitante externa por lo general se presenta destrucción también a nivel de la zona elipsoide. (13)
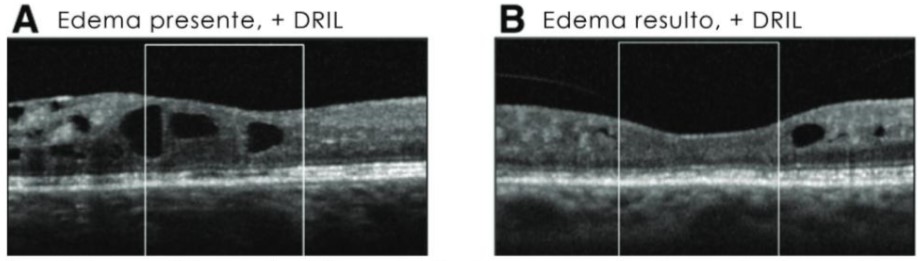
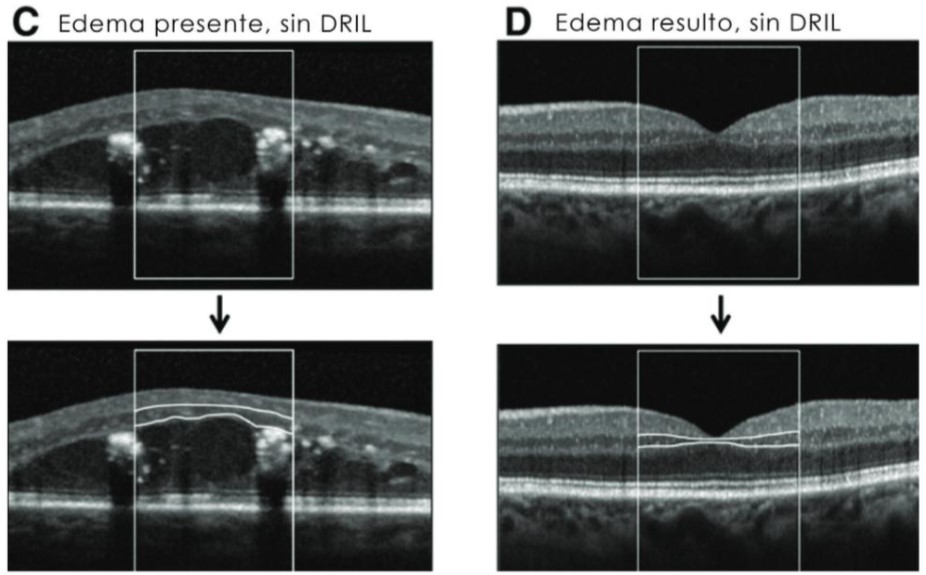
DRIL: es la disrupción de las capas internas de la retina y principalmente de las capas comprendidas entre la nuclear externa, hacia la limitante interna. Esto fue descrito por la doctora Jennifer Sun y colaboradores en el año 2014. Ellos pudieron correlacionar que había una franca disminución de la agudeza visual cuando había presencia de DRIL, aun habiéndose resuelto el EMD. También concluyeron que los cambios tempranos en cuanto a la extensión del DRIL, también se correlacionan con una peor agudeza visual a largo plazo, por lo tanto, por encima de 500 micras de extensión, casi siempre se va a encontrar una visión disminuida, aunque el cuadro del edema se haya resuelto. Luego de este estudio, definitivamente, se viene catalogando como uno de los biomarcadores más robustos y consistentes incluso más que la hemoglobina glicosilada, los niveles de glicemia y el control generalizado de la enfermedad diabética. (14) (15)
CASOS CLÍNICOS
En las siguientes imágenes de OCT del estudio de la doctora Jennifer Sun se puede ver un edema macular diabético con la presencia de DRIL y ya luego de resuelto el edema aún se puede ver que no se puede apreciar la división de las capas internas de la retina en el centro foveal, por lo tanto, este es un paciente que, aunque tenga capas externas íntegras hasta cierto punto, va a tener una disminución de la agudeza visual porque no hay una conducción correcta eferente hacia el cerebro.
REFERENCIAS
- Teo ZL, Tham YC, Yu M, Chee ML, Rim TH, Cheung N, Bikbov MM, Wang YX, Tang Y, Lu Y, Wong IY, Ting DSW, Tan GSW, Jonas JB, Sabanayagam C, Wong TY, Cheng CY. Global Prevalence of Diabetic Retinopathy and Projection of Burden through 2045: Systematic Review and Meta-analysis. Ophthalmology. 2021 nov;128(11):1580-1591. doi: 10.1016/j.ophtha.2021.04.027. Epub 2021 May 1. PMID: 33940045.
- Romero-Aroca P, Baget-Bernaldiz M, Pareja-Rios A, Lopez-Galvez M, Navarro-Gil R, Verges R. Diabetic Macular Edema Pathophysiology: Vasogenic versus Inflammatory. J Diabetes Res. 2016;2016:2156273. doi: 10.1155/2016/2156273. Epub 2016 Sep 28. PMID: 27761468; PMCID: PMC5059543.
- Simó R, Villarroel M, Corraliza L, Hernández C, Garcia-Ramírez M. The retinal pigment epithelium: something more than a constituent of the blood-retinal barrier–implications for the pathogenesis of diabetic retinopathy. J Biomed Biotechnol. 2010;2010:190724. doi: 10.1155/2010/190724. Epub 2010 Feb 17. PMID: 20182540; PMCID: PMC2825554.
- Pieramici DJ, Wang PW, Ding B, Gune S. Visual and Anatomic Outcomes in Patients with Diabetic Macular Edema with Limited Initial Anatomic Response to Ranibizumab in RIDE and RISE. Ophthalmology. 2016 Jun;123(6):1345-50. doi: 10.1016/j.ophtha.2016.02.007. Epub 2016 Mar 15. PMID: 26992841.
- Diabetic Retinopathy Clinical Research Network, Wells JA, Glassman AR, Ayala AR, Jampol LM, Aiello LP, Antoszyk AN, Arnold-Bush B, Baker CW, Bressler NM, Browning DJ, Elman MJ, Ferris FL, Friedman SM, Melia M, Pieramici DJ, Sun JK, Beck RW. Aflibercept, bevacizumab, or ranibizumab for diabetic macular edema. N Engl J Med. 2015 Mar 26;372(13):1193-203. doi: 10.1056/NEJMoa1414264. Epub 2015 Feb 18. PMID: 25692915; PMCID: PMC4422053.
- Tan CS, Chew MC, Lim LW, Sadda SR. Advances in retinal imaging for diabetic retinopathy and diabetic macular edema. Indian J Ophthalmol. 2016 Jan;64(1):76-83. doi: 10.4103/0301-4738.178145. PMID: 26953028; PMCID: PMC4821126.
- Pelosini L, Hull CC, Boyce JF, McHugh D, Stanford MR, Marshall J. Optical coherence tomography may be used to predict visual acuity in patients with macular edema. Invest Ophthalmol Vis Sci. 2011 Apr 25;52(5):2741-8. doi: 10.1167/iovs.09-4493. PMID: 20538987.
- Hwang HS, Chae JB, Kim JY, Kim DY. Association Between Hyperreflective Dots on Spectral-Domain Optical Coherence Tomography in Macular Edema and Response to Treatment. Invest Ophthalmol Vis Sci. 2017 Nov 1;58(13):5958-5967. doi: 10.1167/iovs.17-22725. PMID: 29183041.
- Omri S, Behar-Cohen F, de Kozak Y, Sennlaub F, Verissimo LM, Jonet L, Savoldelli M, Omri B, Crisanti P. Microglia/macrophages migrate through retinal epithelium barrier by a transcellular route in diabetic retinopathy: role of PKCζ in the Goto Kakizaki rat model. Am J Pathol. 2011 Aug;179(2):942-53. doi: 10.1016/j.ajpath.2011.04.018. Epub 2011 Jun 2. PMID: 21712024; PMCID: PMC3157258.
- Hillier RJ, Ojaimi E, Wong DT, Mak MY, Berger AR, Kohly RP, Kertes PJ, Forooghian F, Boyd SR, Eng K, Altomare F, Giavedoni LR, Nisenbaum R, Muni RH. Aqueous humor cytokine levels as biomarkers of disease severity in diabetic macular edema. Retina. 2017 Apr;37(4):761-769. doi: 10.1097/IAE.0000000000001210. PMID: 27471825.
- Funatsu H, Noma H, Mimura T, Eguchi S, Hori S. Association of vitreous inflammatory factors with diabetic macular edema. Ophthalmology. 2009 Jan;116(1):73-9. doi: 10.1016/j.ophtha.2008.09.037. PMID: 19118698.
- Veritti, D., Sarao, V., Francescutti, L., Rota, N., Loewenstein, A., Borrelli, E., … & Lanzetta, P. (2017). Optical coherence tomography angiography findings in diabetic retinopathy. Expert Review of Ophthalmology, 12(6), 475-484.
- Santos AR, Costa MÂ, Schwartz C, Alves D, Figueira J, Silva R, Cunha-Vaz JG. Optical coherence tomography baseline predictors for initial best-corrected visual acuity response to intravitreal anti-vascular endothelial growth factor treatment in eyes with diabetic macular edema: the chartres Study. Retina. 2018 Jun;38(6):1110-1119. doi: 10.1097/IAE.0000000000001687. PMID: 28613220.
- Sun JK, Lin MM, Lammer J, Prager S, Sarangi R, Silva PS, Aiello LP. Disorganization of the retinal inner layers as a predictor of visual acuity in eyes with center-involved diabetic macular edema. JAMA Ophthalmol. 2014 nov;132(11):1309-16. doi: 10.1001/jamaophthalmol.2014.2350. PMID: 25058813.
- Sun JK, Radwan SH, Soliman AZ, et al. Neural Retinal Disorganization as a Robust Marker of Visual Acuity in Current and Resolved Diabetic Macular Edema. Diabetes. 2015;64(7):2560-2570. doi:10.2337/db14-0782
- Cruz MN, Abreu N, Juan A, Báez Y, Dominguez J, Wu L, Batlle J. The SD-OCT and OCT-A profile of DRIL extension in cases of diabetic macular edema refractory to anti-VEGF. PAAO. Honolulu, Hawaii, abril 28, 2018





