Consideraciones generales
La retinopatía autoinmune (AIR, por su sigla en inglés) se refiere a un grupo de enfermedades degenerativas de la retina causadas probablemente por una reactividad cruzada aberrante de autoanticuerpos séricos que afectan antígenos retinianos, de ahí su denominación autoinmune. Las afecciones que conforman la AIR son variadas, con un fenotipo clínico e inmunológico superpuesto. En términos generales, las entidades clínicas de AIR se caracterizan por tener una progresión rápida, así como su deterioro visual. También se afirma que la pérdida de visión es indolora y bilateral. El diagnóstico de AIR es un desafío constante, ya que no se asocia con enfermedad retiniana hereditaria ni con procesos inflamatorios evidentes. (1,2)
La AIR se clasifica en dos grupos: no paraneoplásica (npAIR) y paraneoplásica (pAIR), siendo esta última más adelante denominada retinopatía asociada a cáncer (CAR, por su sigla en inglés), y retinopatía asociada a melanoma (MAR, por su sigla en inglés). Aunque últimamente, en el espectro de alteraciones de AIR, se ha incluido la proliferación melanocítica uveal difusa bilateral (BDUMP, por su sigla en inglés). Con lo anterior se resalta que npAIR ocurre en ausencia de malignidad y corresponde a un criterio de exclusión para el diagnóstico diferencial. Entre sus formas de presentación, se destaca la retinopatía aguda zonal oculta externa. Por otra parte, se describe que npAIR es el tipo más común de esta clasificación y, por ende, se asocia mayormente con etiología autoinmune como lo son la enfermedad tiroidea y enfermedades del tejido conectivo. (1,2)
En el cuadro clínico de AIR, los signos suelen aparecer inicialmente en un ojo, y en su progreso, el otro ojo estará comprometido en un período de 4 días a 2 meses. Por consiguiente, se espera que la presentación de la enfermedad sea bilateral y asimétrica. Rara vez es unilateral. Entre los síntomas principales se encuentra la pérdida de visión subaguda, defectos en el campo visual, escotomas, fotopsias nictalopia y hasta alteraciones de la visión cromática. (3)
En cuanto a la valoración de fondo de ojo, al inicio puede verse con características de normalidad, y posteriormente, mostrar una atenuación vascular discreta. Adicionalmente, se observará atrofia retiniana difusa, cambios pigmentarios y palidez del nervio óptico. Lo anterior se puede acompañar de reacción en cámara anterior como fenómeno de Tyndall o flare y también opacidad leve de vítreo debido a la presencia de celularidad difusa o escasa. Con base en la clasificación de AIR, se indica que los cambios relacionados con la retina aparecen de manera más temprana en CAR y de manera más tardía en MAR, especialmente cuando existen cuadros metastásicos, particularmente en cáncer pulmonar de células pequeñas y genitourinario. (3)
Para el caso particular de BDUMP, el cuadro clínico incluye lesiones múltiples en patrón de panal que se asocia con hiperfluorescencia temprana en la angiografía. También se pueden observar múltiples lesiones melanocíticas en forma de parche con incremento del espesor uveal difuso. Entre tanto, también puede aparecer desprendimiento de retina exudativo, así como catarata opalescente. (3)
En el proceso de diagnóstico, se recomienda realizar un campo visual cada 3 o 6 meses para una mejor observación de la progresión de los escotomas que afectan la visión central o paracentral, así como la evidencia de la constricción del campo. Como examen complementario, es invaluable el uso del electrorretinograma (ERG), en donde se apreciarán hallazgos específicos dependiendo de las células afectadas, ya sean conos, bastones, o células bipolares. En general, el ERG muestra disfunción generalizada retiniana tanto en la modalidad de campo completo, como en el multifocal. También es clásica la reducción de las ondas a y b. En lo específico, en pacientes con CAR se observa una reducción marcada en la función de los conos, mientras que en MAR se presenta una reducción de las ondas b en el ERG de campo completo. (3)
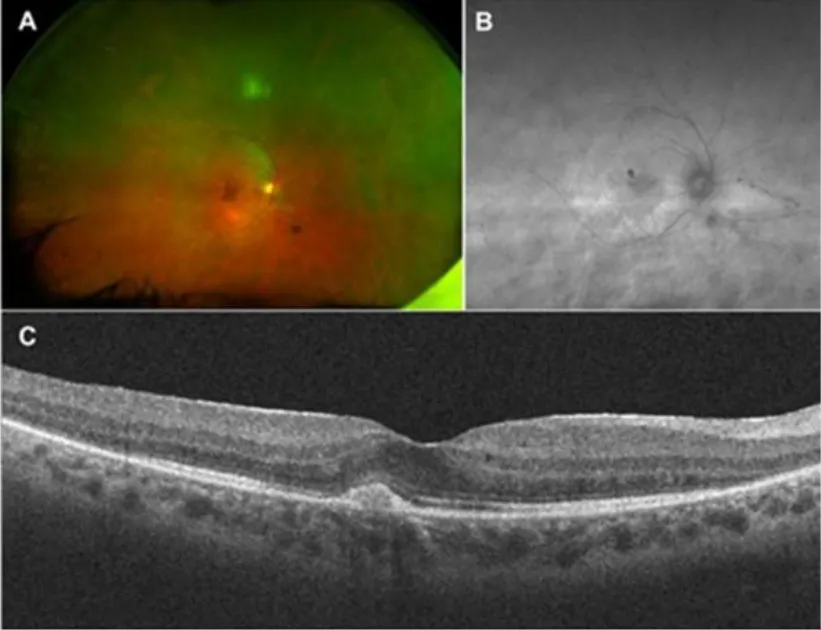
Otro complemento importante en el diagnóstico de AIR es el OCT, que puede evidenciar una disminución en el espesor macular, acompañado de alteraciones de las capas externas de la retina como disrupción de la capa de fotorreceptores y/o de la capa nuclear externa. En el caso de presentarse edema macular cistoide, este hallazgo se puede contrastar con fugas en la región macular en la angiografía con fluoresceína. Hablando de la angiografía con fluoresceína, este es otro examen que se puede usar sobre todo para descartar AIR frente a otras alteraciones que presentan estos patrones de fuga, como la vasculitis. Finalmente, se considera que la autofluorescencia de fondo de ojo es también útil, mostrando un anillo hiperfluorescente en la región parafoveal, correspondiente a las disrupciones que se presentan en la unión de los segmentos de los fotorreceptores. El abordaje clínico integral y la exploración detallada a través de los exámenes complementarios de apoyo diagnóstico permitirán un mejor pronóstico en el tratamiento de AIR. (3) Ver Figuras 1 y 2.

Patogénesis y tratamiento
Lo que se ha dicho hasta el momento de la AIR es que la característica primordial de la entidad es la observación de antígenos antiretina con blancos específicos para destruir algunas especies de antígenos retinianos. En términos generales, estos antígenos son estructuras proteicas que tienen la capacidad de convertirse en inmunógenos. Por lo tanto, lo que se presume es que AIR se desencadena por la formación de anticuerpos específicos contra estas proteínas. Así las cosas, se han identificado más de 17 anticuerpos antiretinianos en AIR. (1)
En el estudio de estas proteínas han llamado la atención especialmente dos de ellas: la recoverina y la enolasa. Recoverina es una proteína de tipo neuronal unida a calcio que se ha detectado primordialmente en los fotorreceptores humanos. Se ha descrito que la recoverina es importante en la inhibición de la rodopsina quinasa, la cual se encarga de la fosforilación de la rodopsina. De esta forma, los anticuerpos anti recoverina causan degeneración de conos y bastones al producirse apoptosis posterior a la unión con el fotorreceptor. La enolasa por su parte, es una enzima glicolítica que se ha detectado en las membranas celulares de las células ganglionares, de las células de Müller, en los conos y en los bastones. Los estudios aún no han podido revelar la forma en la cual los anticuerpos tienen especificidad para estas proteínas convirtiéndolas en antígenos retinianos. Tal vez un fenómeno de mimetismo entre moléculas tumorales y las proteínas retinianas puede ser la etiología principal. (1)
Parte de soporte a la postulación etiológica, es que la recoverina se expresa en alta cantidad en células tumorales en pacientes con AIR. En este sentido, una infección viral o bacteriana también puede actuar como factor desencadenante para iniciar una reacción cruzada entre las proteínas retinianas y las proteínas de los microorganismos. Por lo tanto, el ambiente tóxico del medio hará que estos anticuerpos citotóxicos conlleven a la apoptosis y, por ende, a la muerte celular. Aunque se aclara que todas las células retinianas se pueden alterar por estos mecanismos, las más afectadas serán los fotorreceptores, células bipolares y células ganglionares, afectando así la funcionalidad de la retina neural. (1)
En cuanto a la pérdida de visión, se ha identificado que la AIR asociada a la recoverina afecta más que la asociada a la enolasa en lo que se refiere a la presentación aguda y a la mayor rapidez en la progresión del daño. La anterior teoría aún deja algunas dudas en el sentido de observar que algunos pacientes tienen estos anticuerpos y aun así, no manifiestan los procesos degenerativos. Se cree en este caso que la presencia de estos anticuerpos en personas normales se origina por procesos de degradación celular, posterior a la exposición de autoantígenos al sistema inmune. Ver figura 1. (1)
En cuanto a la frecuencia de presentación, generalmente AIR tiene una mayor prevalencia en mujeres entre la 5ta o 6ta década de vida, así como en pacientes con antecedente de enfermedad autoinmune, especialmente hipotiroidismo. Se debe tener especial cuidado en el sentido de que la retinitis pigmentosa es un diagnóstico diferencial, ya que AIR también presenta cambios en el epitelio pigmentario. Es importante recordar que estos cambios son producto de la respuesta inmune del ojo mediante el control de la barrera hematorretiniana, y se tomará como reflejo del daño que sucede en los fotorreceptores. (1)
Para el tratamiento de AIR, es importante analizar si su origen es paraneoplásico (pAIR) o no neoplásico (npAIR). De tal manera que, es indispensable el seguimiento multidisciplinario con médicos oncólogos. Por lo tanto, la forma (pAIR) requiere intervención con el objetivo de reducir el tumor a través de estrategias como la radioterapia o la quimioterapia. En el abordaje ocular, se ha descrito el uso de inmunosupresores locales y sistémicos. En otros escenarios, también se ha reportado como manejo inicial al corto plazo la administración de corticosteroides vía inyección intravítrea o sub-Ténon como la triamcinolona. Como segunda línea de manejo, se ha recomendado el uso de inmunosupresores antimetabolitos como el micofenolato, la azatioprina, y los inhibidores de células T. (2)
Para el caso de resistencias al tratamiento, se ha sugerido el uso de anticuerpos monoclonales anti-CD20 como el Rutixumab, así como la administración de inmunoglobulina intravenosa. También se reporta la opción de la plasmaféresis como opción efectiva antes de que ocurra la disminución de la visión, ya que, al contribuir con la disminución de los anticuerpos circulantes, reduce el daño a nivel de los fotorreceptores. Esta estrategia cobra mayor importancia en pacientes con BDUMP. En fin, las estrategias dependerán de la oportunidad del diagnóstico. Po9r ejemplo, el uso de implantes intravítreos de dexametasona también ha mostrado mejoría en pacientes con AIR. (2)(3)
Debido a la dificultad en el diagnóstico y a que diferentes pruebas moleculares son aún imprecisas, es necesario un monitoreo constante y multidisciplinar cuando se sospecha de AIR, sobre todo en presencia de antecedente de autoinmunidad o cáncer.
Referencias
1. Dutta Majumder P, Marchese A, Pichi F, Garg I, Agarwal A. An update on autoimmune retinopathy. Vol. 68, Indian Journal of Ophthalmology. Wolters Kluwer Medknow Publications; 2020. p. 1829–37.
2. Raevis J, Etheridge T, Cleland S, Mititelu M. Autoimmune retinopathy: findings and limitations from optical coherence tomography angiography. Int J Retina Vitreous. 2020 Dec 1;6(1).
3. Roisman L, Rossetto JD, Goldhardt R. Autoimmune Retinopathy, Testing, and Its Controversies. Vol. 9, Current Ophthalmology Reports. Springer; 2021. p. 178–83.





